Volume 39 Number 2
Avoidance of lower limb amputation from a diabetic foot ulcer: The importance of multidisciplinary practice and patient collaboration
Margaret Mungai and Emmy Sirmah
Keywords Diabetes, diabetic foot ulcer, debridement, nursing interventions, patient education, multidisciplinary collaboration
For referencing Mungai M and Sirmah E. Avoidance of lower limb amputation from a diabetic foot ulcer: The importance of multidisciplinary practice and patient collaboration. WCET® Journal 2019; 39(2):19–27
DOI https://doi.org/10.33235/wcet.39.2.19-27
Abstract
This article explores wound care nursing interventions and inter-professional collaboration for a patient referred with a stage 3 diabetic foot ulcer (DFU). To the patient’s distress, he had been informed that he may require an amputation due to the severity of his DFUs. On initial presentation, the patient was symptomatic for peripheral neuropathy, infection and hyperglycaemia. The left lower limb was oedematous and there was a DFU at the metatarso-phalangeal joint of the big toe on his left foot secondary to haemorrhagic callus. Progressive healing of the DFU was realised over time by repetitive debridement; incision and drainage of the DFUs; antibiotic therapy; appropriate footwear; dietary instructions; control of the blood sugar levels (BSLs); and patient and family education.
Wound care nursing interventions were applied in conjunction with medical management of the DFUs. The DFUs were managed using a locally made, two-part zinc oxide gauze dressing known as the Unna boot. A family member was instructed how to continue applying the dressings at home in between clinic visits. Complete wound healing was eventually achieved within four months, thus avoiding the need for amputation.
Introduction
Diabetes mellitus (DM) will be the seventh leading cause of death by 2030 as predicted by the World Health Organization1. About 80% of deaths due to DM occur in low- to medium-income countries2,3.
Foot ulceration is the main complication affecting lower limb extremities in patients with DM, the management of which is costly. The global prevalence of risk of diabetic foot ulcers (DFUs) in patients with DM is 40–70%4. The prevalence of DM in Kenya ranges between 2.2%5 and 2.4%6.
The International Working Group on the Diabetic Foot (IWGDF) defines a DFU as an, “Infection, ulceration or destruction of tissues of the foot associated with neuropathy and/or peripheral artery disease in the lower extremity of a person with [a history of] diabetes mellitus”7. Within a cohort of 1788 patients with DM at Kenyatta National Hospital, the prevalence of DFUs was 4.6% (n=84)8.
DFU development is associated with multiple risk factors, which can be grouped into systemic factors and local factors. The primary systemic factors are diabetic peripheral neuropathy (DPN) and peripheral arterial disease (PAD). Other systemic factors include: peripheral vascular disease, chronic renal disease, male gender, abnormal glycated haemoglobin level (HbA1c), more than 10 years' duration with DM, advancing age, a high BMI, obesity and retinopathy. Local factors include foot deformity, high plantar pressures and haemorrhagic callus formation, infection, shear, pressure and stress on the lower extremities due to poorly fitting footwear, other external trauma; and, suboptimal self-care habits8-11.
The majority of DFUs develop from minor trauma in the presence of sensory neuropathy or loss of protective sensation, which is associated with poor blood supply due to micro-vascular disease from DM12. Foot infection in patients with DM is common, with more than 50% of patients with DFUs having an infected ulcer13. These infections can range from simple infections, cellulitis and abscess formation to more severe infections such as pyomyositis, osteomyelitis and gangrene14,15.
In addition to the classic signs of infection (heat, pain, redness, swelling) DFUs exhibit signs of inflammation or purulence. Other signs of infection in DFUs are malodour, high temperature within 4 cm of the ulcer margin, non-purulent or purulent secretions, friable or discoloured granulation tissue, undermining of wound edges, continuous wound breakdown, and evidence of poor wound healing10,16-18. Patients with DFUs are at increased risk of infection if they have experienced one or more of the following: a traumatic wound, an ulcer for more than 30 days, a history of walking barefoot, a wound that probes to bone, previous lower extremity amputation and loss of protective sensation16.
The Wagner Diabetic Foot Ulcer Classification System is commonly used to classify DFUs by grading ulcer depth and presence of infection from 0 to 5. DFUs that have abscesses, joint sepsis or osteomyelitis are usually deep ulcers that are grade 3 within the Wagner Diabetic Foot Ulcer Classification System16,19.
The current approach in the management of patients with DM focuses heavily on the prevention of DFU formation and/or recurrence3 and lower extremity amputations (LEAs). Preventive multidisciplinary care in DFU aimed at conservative treatment is less costly compared to amputation costs incurred by patients and health services20. In addition, health care providers should aim to improve the health-related quality of life of patients with DFUs, which is low in this patient cohort21.
Case Study
Patient overview and presenting complaint
Mr MM, a 59-year-old male, was referred from the company clinic to our hospital with uncontrolled DM, gradual loss of vision and a haemorrhagic callus on his left big toe.
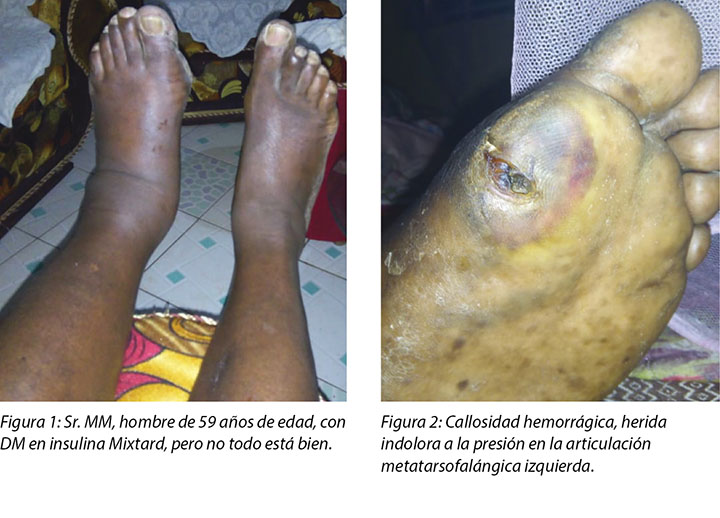
On presentation at the Moi Teaching and Referral Hospital DM clinic, Mr MM’s left leg was oedematous (Figure 1) and the haemorrhagic callus (Figure 2) at the metatarso-phalangeal joint of the big toe was clearly evident. His medical history indicated he had had DM since 1996, developed hypertension in 2000 and was treated for cellulitis in his right big toe in August 2017 that healed well. His medications included Mixtard insulin 20 international units in the morning and 10 international units in the evening. Mr MM had been unable to control his blood sugar levels (BSLs) and his fasting blood sugar now ranged between 20 and 22 mmol.
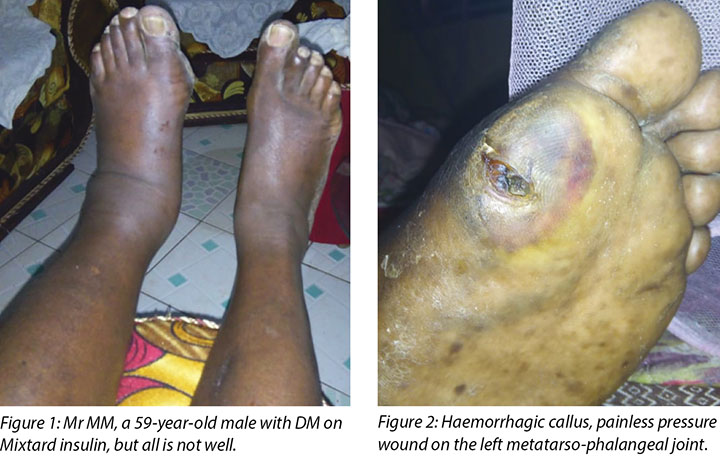
Mr MM had not noticed anything untoward with his foot or toe until the area became very painful and he asked his son to check his feet. He thought the problem was due to poorly fitting shoes, which he had used for some time. He reported no history of trauma; however, he had little sensation in the foot area. He had little appetite and had lost weight from 150 kg to 140 kg. His eyesight had deteriorated to the extent that he could no longer read the daily newspaper.
On his initial visit to the wound care clinic, he was brought in a wheelchair and looked depressed. He stated that if he had to have an amputation, he would not be able to use crutches due to his poor eyesight and heavier body weight.
Interventions and wound management plan
Foot assessment
On palpation, both dorsalis pedis and posterior tibial pulses were absent on the left leg, but were well palpable on the right leg.
His ABI was at 0.92 with an ankle systolic pressure of 168 mmHg and an arm systolic pressure of 154 mmHg. Self-foot care assessment indicated that Mr MM required assistance due to body weakness, poor vision and not reaching his feet. Health information on the effects of DM on the foot among other body parts was provided to the son and brother-in-law, who accompanied him including inspection under light for any abnormality/deformities.
Loss of sensations was detected by touching his foot at different parts with his eyes closed because neither the Semmes Weinstein monofilaments nor the Doppler machine are available at the wound care clinic. Mr MM's capillary refilling time on his toes was 4–5 seconds; however, there was no associated sensation experienced by Mr MM when this assessment was undertaken.
Wound debridement
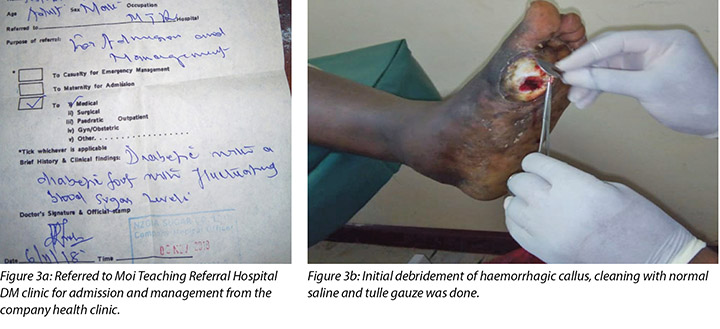
During Mr MM’s initial visit to the DM clinic the callus beneath his left metatarso-phalangeal joint of the big toe was debrided. Following this initial debridement of the callus the wound was classified as a stage 2 DFU using the Wagner Diabetic Foot Ulcer Grade Classification System (Figure 3).
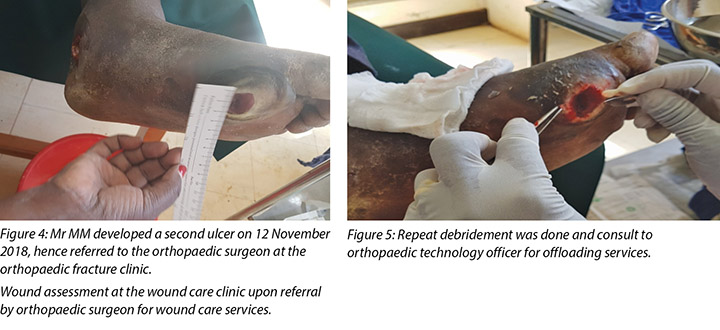
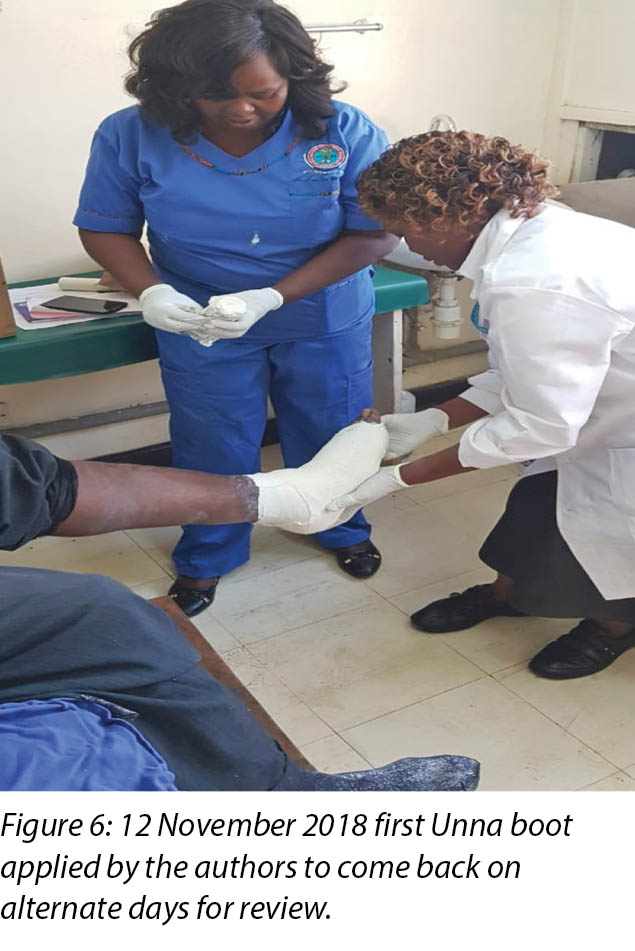
At the first visit in the wound care clinic on 12 November 2018, wound assessment, cleaning with warm water, repeat debridement and application of the locally produced two-part zinc oxide Unna boot was done (Figures 4, 5 and 6) and Mr MM was advised to come back in two days' time.
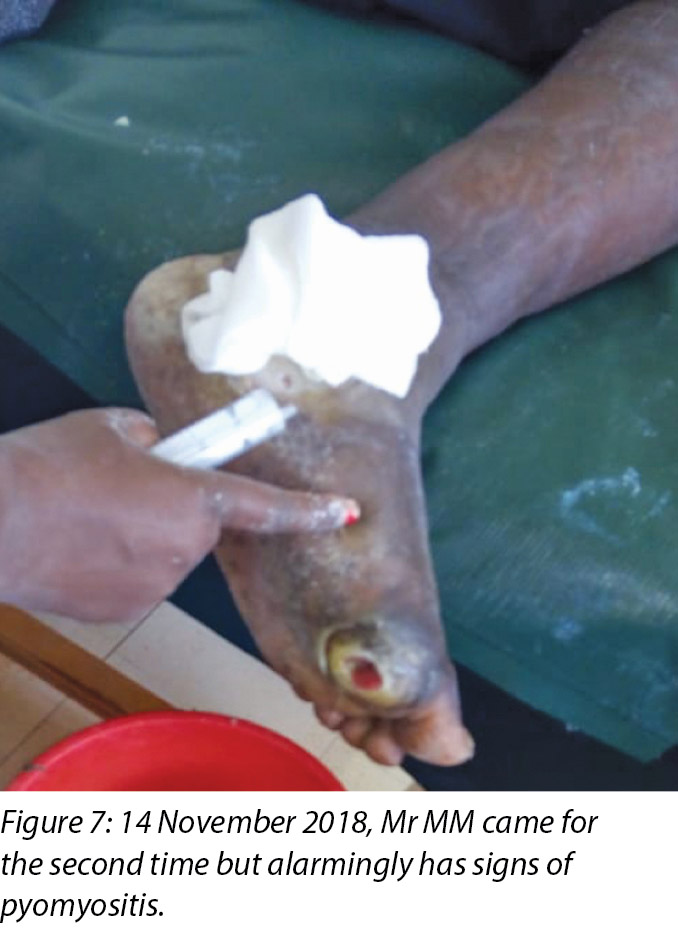
Mr MM's foot was noted to be very warm with localised swelling and pitting oedema on the second visit on 14 November 2018 (Figure 7) when Mr MM was due for the second application of the Unna boot, which we had scheduled on alternate days after the first application. The clinical diagnosis of pyomyositis was arrived at based on the signs and symptoms present in the foot, which were the presence of an abscess and localised oedema. The affected foot felt hot on palpation, with a body temperature of 37.8°C by use of the clinic infrared thermometer. Mr MM could slightly move all toes of the left foot including a small range of dorsiflexion and plantar flexion upon instructions.
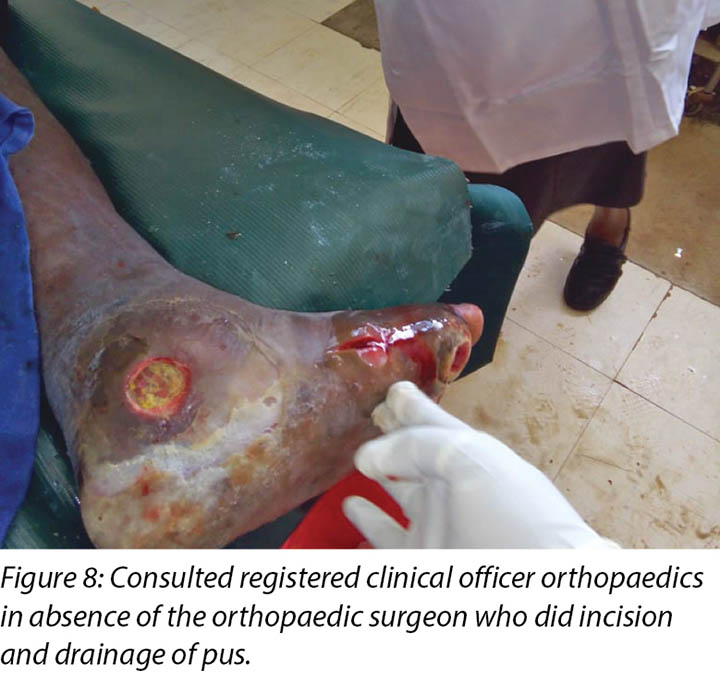
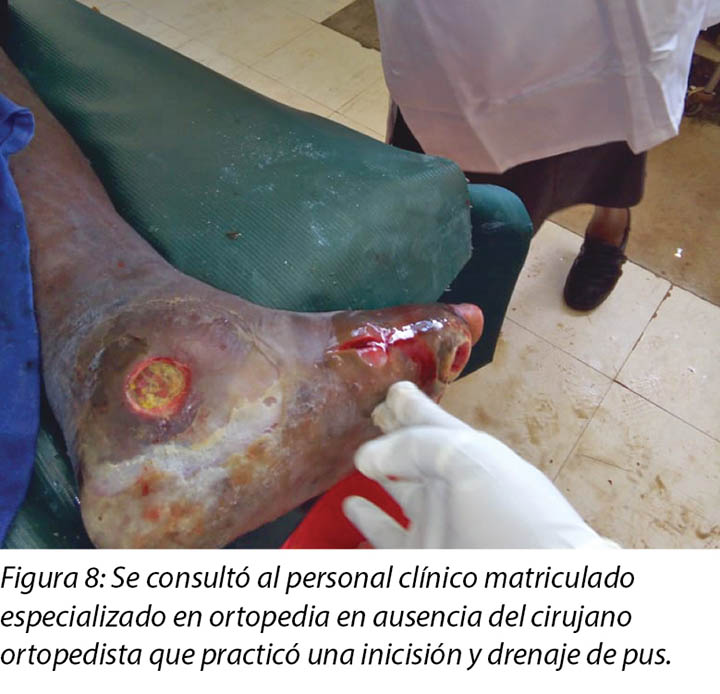
Local incision and drainage of the pyomyositis as well as sharp debridement of necrotic tissue and residual periwound callus was undertaken within the clinic. Antibiotic therapy was commenced with a course of Clindamycin to combat the infection associated with the pyomyositis. This was given at 1 gram orally every 8 hours for 7 days. Unfortunately, a pus swab for culture and sensitivity to identify the specific causative agent was unable to be obtained at the time (Figures 8 –11). Mr MM's DFU was now re-classified to stage 3 on the Wagner Diabetic Foot Ulcer Classification, having developed into a deep ulcer with abscess formation.
Mr MM noticed the first wound, which was painless with haemorrhagic callus (Figure 2), on 5 November 2018; hence he visited the company health facility on 6 November 2018. He was advised to come to our hospital for further management, but only arrived at the DM clinic on 10 November 2018. Debridement of the haemorrhagic callus and grading of the first wound was done (Figure 3a and b).
The second wound was noted on 12 November 2018 when he went for review at the DM clinic as advised and this was when he was referred to the orthopaedic surgeon at the orthopaedic clinic for further evaluation. It was at this point the orthopaedic surgeon after his review advised the patient to come to our wound care clinic for wound care services.
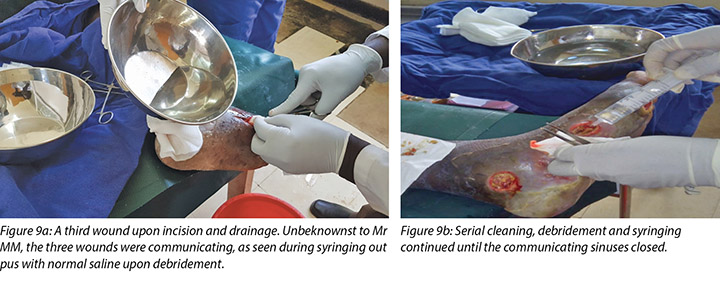
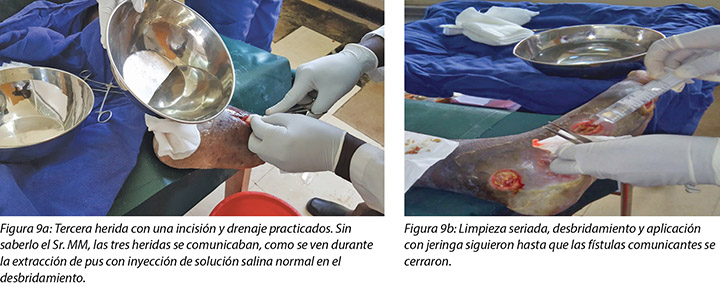
The third wound developed on 14 November 2018 upon incision and drainage of the pus due to pyomyocitis, which was noted on examination of the wound before cleaning (Figures 7 and 8). The three wounds were noted to be communicating when syringing out pus was being carried out upon debridement (Figure 9).
Wound management
At the DM clinic, the wound had initially been cleaned with normal saline, debrided using a surgical blade and artery forceps and dressed with SufraTulle and gauze dressing.
At the wound care clinic, wound cleaning was done with warm tap water, serial sharp debridement using a surgical blade and artery/dissecting forceps was done under no anaesthesia/analgesics as Mr MM was not feeling pain at all and the application of a locally produced two-part zinc oxide dressing was also done.
As Mr MM had a degree of left lower limb oedema (Figure 1) that indicated circulatory stasis this necessitated the use of slight compression during the initial period of Unna boot dressing application. Compression was eventually stopped with consequent dressing once all oedema subsided.
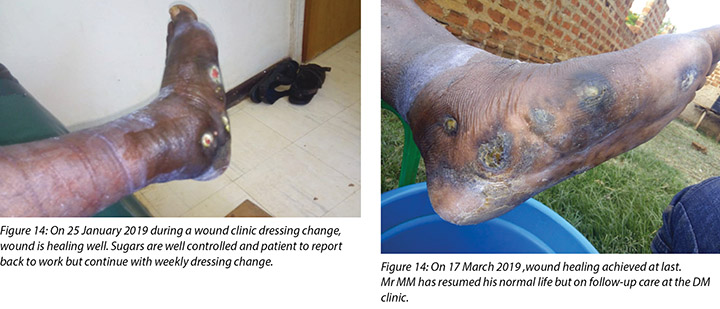
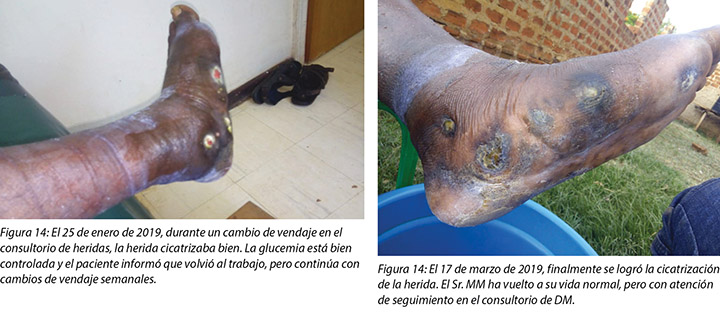
At each subsequent dressing change the wound was debrided as required and application of a locally manufactured zinc oxide dressing (Unna boot) done. The first Unna boot was applied on 12 November 2018 after repeat debridement (Figures 5 and 6). The second dressing change with the Unna boot was carried out on 14 November 2018 after incision and drainage. The third Unna boot dressing change was on 16 November 2018 and thereafter continued every Monday and Friday as an outpatient for a period of two months. The frequency of debridement with debridement was adjusted to every Monday and for the whole of the third month as we taught the son how to undertake the dressing changes at home. He would thereafter change the dressing on a Monday then come to the clinic fortnightly for us to assess the patient and the wound as well as evaluate his dressing change skills. This regime was continued with the locally produced zinc oxide dressing — Unna boot — as the primary dressing at the clinic and at home until complete healing of the three wounds was achieved on 17 March 2019 after a period of four months.
Multidisciplinary approach
The management of Mr MM's DFUs was complex, requiring a multidisciplinary team approach to guide his care.
Orthopaedic surgeon
Mr MM's first visit and debridement of haemorrhagic callus was on 10 November 2018. The second ulcer developed or was noted on 12 November 2018 when Mr MM came to the DM clinic for the second time after which he was referred to the orthopaedic surgeon. The orthopaedic surgeon evaluated the foot pulses at the dorsalis pedis, posterior/anterior tibial and ordered foot x-rays. Upon reviewing the x-rays report, he referred the patient for wound care services since there was no bone involvement.
Pyomyositis was later diagnosed on 14 November 2018 which led to the development of the third wound upon incision and drainage by the registered clinical officer orthopaedics (Figures 8 & 9a). It was not possible to involve the orthopaedic surgeon at the time, but the clinical officer also specialised in orthopaedics and worked closely with the orthopaedic surgeon completed the incision and drainage as well as prescribing the oral Clindamycin 1 g eight hourly for 7 days.
Orthopaedic technologist: foot and pressure offloading
A key intervention in the management of Mr MM's DFUs was offloading of pressure on his affected foot. He was reviewed by an orthopaedic technologist and was advised about the benefits of offloading as well as changes required to his shoes. In accordance with the advice form the orthopaedic technologist, his shoes were changed to open padded shoes rather than enclosed shoes.
Dietitian
A dietitian, diabetes educator and nursing staff provided advice on dietary requirements, control of BSLs and general health education inclusive of daily foot examination and care to both Mr MM and the relatives.
Psychosocial support
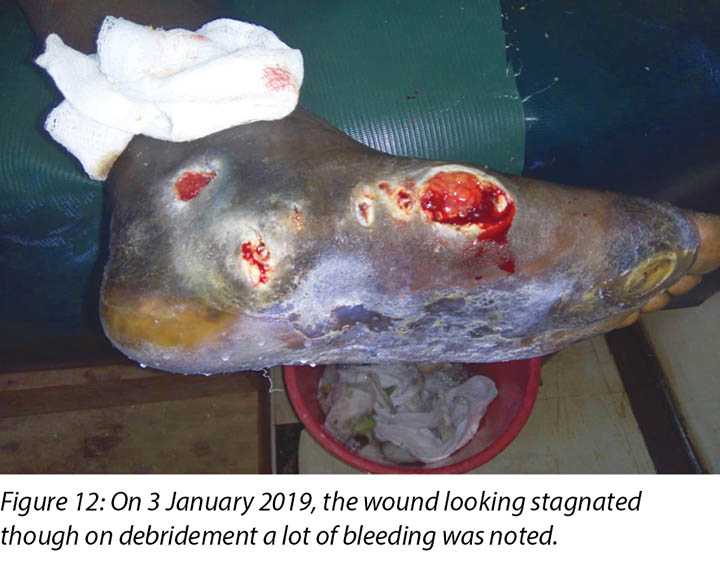
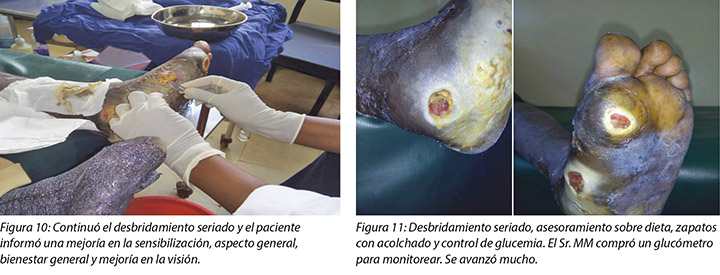
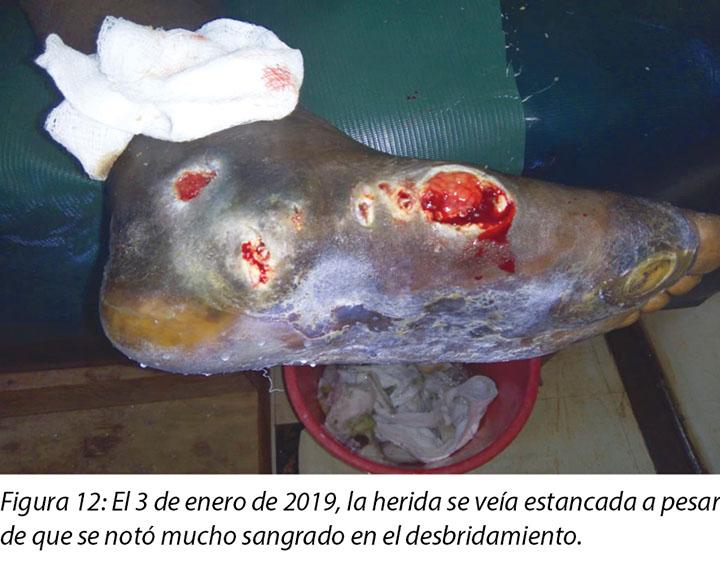
At times, the DFUs showed signs of stagnation in wound healing where there were no changes to the status of the wound (Figure 12). In these instances, counselling and psychological support was offered to Mr MM that this often occurred with wounds of this nature. He was encouraged to continue with all aspects of his treatment regimes.
Discharge planning, community care and long-term follow-up
A family therapy session was undertaken with Mr MM, Mr MM’s wife and son on home-based wound care, dietary regime, foot examination and BSL monitoring. The importance of Mr MM actively participating in his self-care where possible was stressed to avoid deterioration and/or recurrence of his DFUs and improve his overall well-being.
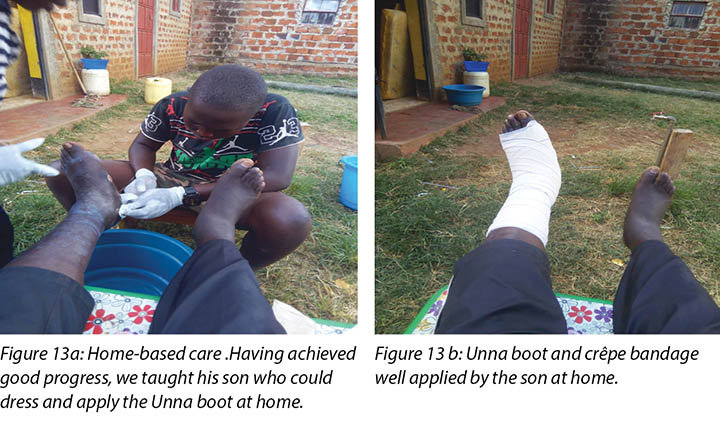
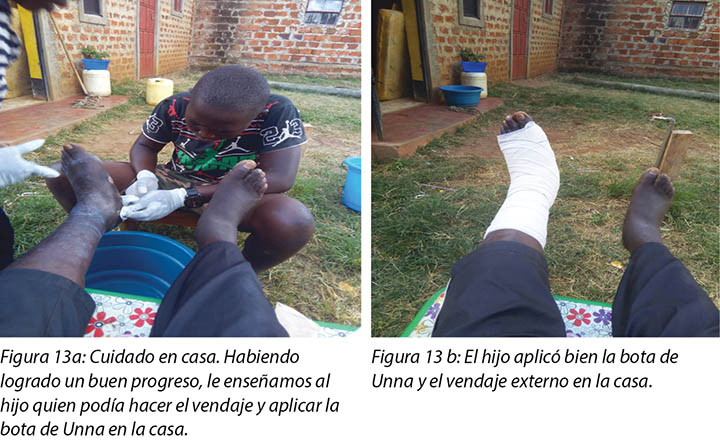
Mr MM's wife and son were taught how to examine the wound, check for pre-ulcerative signs on the foot and apply the Unna boot wound dressing (Figure 13a and 13b). Education was also provided on how to recognise ill-fitting or inadequate footwear, given that the wearing of adequate footwear is a key factor in preventing DFU recurrence.
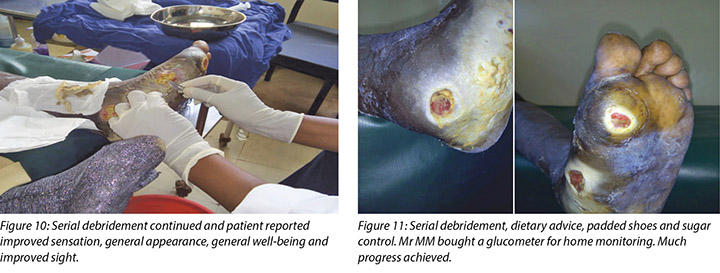
Mr MM purchased a glucometer for home monitoring of his fasting BSLs, which had stabilised at 6–8 mmol/L.
Discussion
Most patients with DM will suffer from a DFU at one time during their lifetime22. DFUs are a cause of high morbidity and mortality that also incur substantial financial costs23.
Diabetic neuropathy causes defects in pain sensation from the loss of sensory perception in the foot; hence the lack of early care-seeking behaviour by patients with diabetic neuropathy. Insensate feet are susceptible to increased shear and pressure on the plantar surfaces or soles of the foot and consequently increased injury24. Motor neuropathy causes wasting of intrinsic foot muscles while autonomic neuropathy affects sweating with dryness and scaling of the feet. These phenomena lead to ulcer development, foot deformity and defects in joint mobility.
The management of patients with DFUs is, unfortunately, often implemented by health care providers whose existing knowledge and insight into causative factors, diagnosis and management of DFUs is suboptimal. Even in developed countries, diabetes specialists refer patients to community nursing services where the nurses lack the requisite knowledge and clinical competency to manage such wounds proficiently25.As a multifaceted problem, evidence-based protocols, strengthening of multidisciplinary team functioning and specific health care facility clinical regimens achieve better outcomes. Nurse-based foot care programs have been found to be effective in the prevention of DFUs26.
Nurses are responsible for the management of DFUs referred for wound care services at the Moi Teaching and Referral Hospital, Kenya. The hospital management has enabled one orthopaedic surgeon, two nurses, one registered clinical officer, one physiotherapist and one occupational therapist to undertake the IIWCC wound care course at Stellenbosch University RSA from 2010 to date.
Diabetes Kenya, formerly called Kenya Diabetes Association, works closely with the International Diabetes Federation to enable training of multidisciplinary diabetes educators in our hospital who are currently six in number (three nurses, one registered clinical officer and two physicians). These teams (wound/diabetes) organise in-house training for other staff in the hospital as well as attending national conferences and seminars when possible to enhance their knowledge and practice geared towards developing an enthusiastic wound community of practice at the hospital.
Mr MM was referred from a company clinic more than 100 kilometres away due to lack of health care providers who felt comfortable in managing his DFU.
The management of DFUs is often complex and requires a multidisciplinary approach to achieve optimal patient outcomes. The multidisciplinary team can: reduce the incidence of DFU complications and associated severity of those complications; reduce amputations; improve a patient’s quality of life; and, increase their life expectancy22. In this case, the collective clinical input from the orthopaedic surgeon, the orthopaedic technologist, dietitian, counsellor and nursing staff in conjunction with Mr MM’s family were able to salvage Mr MM’s foot, facilitate wound healing and avoid amputation of part or all of his foot. Key interventions in the management of Mr MM’s wounds were wound debridement, local wound care, pressure offloading and stabilisation of Mr MM’s BSLs, patient education and psychosocial support.
Wound debridement of devitalised, unhealthy tissue to expose healthy, bleeding tissue allows for greater visualisation of the extent of the ulcer and the presence of indwelling abscesses or sinuses27,28. Further, it decreases the risk of spreading infection, and reduces periwound pressure from the presence of callus, all of which enhance normal wound contraction and healing29.In patients with DFUs, it is estimated that 20% of those with moderate to severe infections require an amputation at some level30,31. Conservative sharp wound debridement was, therefore, undertaken at every dressing change.
The wound care regimen consisted of cleaning with warm tap water, sharp debridement by surgical blade and artery/dissecting forceps, syringing with normal saline using a 20 cc syringe and application of the primary zinc oxide dressing with a 6-inch crêpe bandage for the outer dressing.
The frequency of the serial debridement and dressing change was initially on alternate days for the first week due to the infection, followed by every Monday and Friday (twice a week) and thereafter every Monday (once a week) but the son would do it at home for one week then come to the clinic fortnightly during the fourth month of wound care.
The application of a locally manufactured zinc oxide dressing (Unna boot) alongside key basic wound care principles was used for a period of four months to facilitate wound healing. Zinc oxide within the dressing is thought to decrease inflammation, protect the surrounding skin, enhance re-epithelisation and reduce oedema. The Unna boot zinc oxide bandage dries to form a warm, snug boot around the lower limb that supports venous return by providing high pressure with muscular contraction when the patient walks but little pressure on resting, which aids healing of the ulcer.
While patients are accepting of this dressing it is imperative staff are trained in the correct foot and wound assessment and application of this dressing to avoid constriction of the limb and arterial occlusion in the presence of neuropathy32-34. It was important to assess the vascular flow along the dorsalis pedis and posterior tibial arteries29 before applying any compression to a lower limb. Mr MM reported he felt more secure and confident with his left leg upon application of the Unna boot.
Ideally, management of DFUs requires the person to be non-weight bearing on the affected area to enhance healing. There are a variety of strategies to off-load the pressure from DFUs, including off-the-shelf orthotic footwear, customised footwear including insoles, contact casting and external padding that can be moulded to suit the contours of the foot. The type of offloading used depends on patient and environmental factors, access to and cost of orthotic footwear35,36. Taking these factors into consideration and to facilitate off-loading of Mr MM’s DFU, the orthopaedic technologist advised the use of open, padded shoes. The orthopaedic technologist did not place any additional padding on Mr MM's foot, but recommended larger padded, open shoes to alleviate pressure on the wounds. He advised that the shoes Mr MM was wearing were tight with non-padded straps and buckles that led to the development of the second wound.
DFUs seriously affect health-related quality of life due to reduced accomplishment of physical activities of daily living that affects psychological and social well-being. This can lead to social isolation in general, tension that adversely affects family relationships, financial hardship from loss of productivity or job loss and emotional stress and depression within the person with the DFU37. These factors, however, are influenced by an individual patient’s clinical characteristics, including social demographic and environmental factors38.
Self-care is a primary factor in attaining optimal health and management of DM. This can be effectively achieved by the use of nursing theories and models such as Orem’s Self-care Model38. Borji et al. state that, “Self-care is considered as an important and valuable principle because it emphasizes the active role of people in their own healthcare, not the passive. Further, … Self-care behaviour is affected by the total skills and knowledge that a person (or relatives) has and uses for his practical efforts”, to alter those factors that affect a person’s health and well-being39.
Consequently, nurses play a key role in patient and family education by assisting patients and their families to understand the underlying causes of DM and DFUs. This knowledge allows patients and their families to play an active role in problem solving and decision making with respect to their clinical and psychosocial care40,41.
Educating Mr MM and his family about his diet and the importance of diet and exercise in assisting to stabilise his DM and BSLs was one example of self-care where Mr MM was able to be an active participant in his care.
Nursing staff also provided clinical education to Mr MM’s wife and son on how to manage Mr MM’s wounds and foot care at home. This included the application of the Unna boot dressing (Figures 13a and 13b) at home.
As there is a high possibility of developing a new ulcer after successful treatment of a DFU on the same site or on a different site of the same limb or the contra-lateral limb42, following up Mr MM as an outpatient has been maintained to ensure his DFU does not re-occur, which is very important.
Variants of diabetic foot complications are more prevalent now. This is due to the increased global incidence of DM as well as the longer life expectancy realised with better management. This requires a paradigm shift for DM care providers to focus on current and emerging trends for prevention, diagnosis and management of DFUs among other diabetic foot complications27. There is the need, therefore, to direct DM education and management of diabetic wounds towards health professionals as much as the patients because health care providers and health professionals can contribute to development as well as deterioration of DFUs43. The increase in DM and DFUs globally requires the attention of all health care professionals and, in particular, the adoption of effective multidisciplinary team approach to diagnosis and management, inclusive of nursing and patient participation44.
Conclusion
The incidence of DM and DFUs is escalating around the world. Not all health care providers and health professionals are sufficiently educated to assess and manage DFUs. The referral of patients with DFUs to health care facilities with expertise in the assessment and management of DFUs is critical to successful patient and health provider outcomes.
Referral of Mr MM to our hospital, where a multidisciplinary approach to the management of his DFU was adopted, facilitated wound healing, limb salvage and prevention of an unnecessary amputation of his lower left leg, which undoubtedly improved his overall quality of life.
Nurses with expertise in wound management applied self-care theory to educate Mr MM and his family regarding his DM, BSL control and monitoring, care of his wounds and care of his feet within the clinic and community settings.
Acknowledgements
We wish to thank Dr Aileen Chang of the University of California and a visiting lecturer at Moi University/Ampath Eldoret, for her guidance in writing this manuscript.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Cómo evitar la amputación de una extremidad inferior por una úlcera de pie diabético: la importancia de la práctica multidisciplinaria con la colaboración del paciente
Margaret Mungai and Emmy Sirmah
DOI: https://doi.org/10.33235/wcet.39.2.19-27
Resumen
Este artículo analiza las intervenciones de enfermería con respecto al cuidado de las heridas y a la colaboración interprofesional para un paciente derivado con una úlcera de pie diabético (DFU, por sus siglas en inglés) de grado 3. Para angustia del paciente, se le había informado que podía ser necesario realizarle una amputación debido a la gravedad de su DFU. En la presentación inicial, el paciente estaba asintomático con respecto a la neuropatía periférica, infección e hiperglucemia. El miembro inferior izquierdo estaba edematoso y había una DFU en la articulación metatarsofalángica del dedo gordo de su pie derecho como consecuencia de la callosidad hemorrágica. Con el tiempo se le realizó una cicatrización progresiva de la DFU por medio de un desbridamiento repetitivo; una incisión y drenaje de las DFU; un tratamiento antibiótico; un calzado adecuado; instrucciones alimentarias; un control de los niveles de glucemia (BSL, por sus siglas en inglés); y educación del paciente y de la familia.
Se realizaron intervenciones de enfermería para el cuidado de las heridas junto con un tratamiento médico de las DFU. Se trataron las DFU utilizando un vendaje de gasa con dos partes de óxido de zinc, fabricado localmente, conocido como bota de Unna. Se instruyó a un miembro de la familia sobre cómo continuar con la aplicación de los vendajes en la casa entre visitas clínicas. Finalmente se logró la cicatrización completa de la herida dentro de los cuatro meses; por consiguiente, se evitó la necesidad de amputación.
Introducción
La diabetes mellitus (DM) será la séptima causa principal de muerte para 2030, según lo predice la Organización Mundial de la Salud1. Aproximadamente un 80 % de las muertes debido a DM ocurren en países de mediano a bajo ingreso2,3.
La ulceración del pie es la principal complicación que afecta las extremidades inferiores en pacientes con DM, cuyo tratamiento es costoso. La prevalencia global del riesgo de úlceras de pie diabético (DFU) en pacientes con DM es de 40–70 %4. La prevalencia de DM en Kenia varía entre 2,2 %5 y 2,4 %6.
El Grupo de Trabajo Internacional sobre el Pie Diabético (International Working Group on the Diabetic Foot, IWGDF) define a la DFU como: “Infección, ulceración o destrucción de tejidos del pie asociados con neuropatía o enfermedad arterial periférica en las extremidades inferiores de una persona con [historia de] diabetes mellitus”7. Dentro de un grupo de 1788 pacientes con DM en el Kenyatta National Hospital, la prevalencia de DFU era de un 4,6 % (n=84)8.
El desarrollo de la DFU está asociado con múltiples factores de riesgo, que se pueden agrupar en factores sistémicos y en factores locales. Los factores sistémicos primarios son la neuropatía periférica diabética (NPD) y la enfermedad arterial periférica (EAP). Otros factores sistémicos incluyen: enfermedad vascular periférica, enfermedad renal crónica, género masculino, nivel anormal de hemoglobina glicosilada (HbA1c), más de 10 años con DM, edad avanzada, un alto IMC, obesidad y retinopatía. Entre los factores locales se incluyen la deformidad del pie, las altas presiones plantares y la formación de callosidades hemorrágicas, la infección, el resquebrajamiento, la presión y el estrés en las extremidades inferiores debido al uso de calzado inadecuado, otros traumas externos y hábitos de autocuidado deficientes8-11.
La mayoría de las DFU se desarrollan a partir de traumatismos menores en presencia de neuropatías sensoriales o de pérdida de la sensibilidad protectora, que está asociada con un flujo sanguíneo deficiente debido a la enfermedad microvascular de la DM12. Es común la infección del pie en pacientes con DM y más del 50 % de los pacientes con DFU tienen úlceras infectadas13. Estas infecciones pueden incluir desde infecciones sencillas, celulitis y formación de abscesos hasta infecciones más graves, tales como piomiositis, osteomielitis y gangrena14,15.
Además de los síntomas clásicos de infección (calor, dolor, enrojecimiento, hinchazón), las DFU muestran síntomas de inflamación o purulencia. Otros síntomas de infección en las DFU son mal olor, temperaturas altas dentro de los 4 cm del borde de la úlcera, secreciones purulentas y no purulentas, tejido de granulación descolorido y quebradizo, socavamiento de los bordes de la herida, deterioro continuo de la herida y evidencia de cicatrización deficiente de la herida10,16-18. Los pacientes con DFU tienen mayor riesgo de infección si han sufrido una o más de las siguientes condiciones: una herida traumática, una úlcera durante más de 30 días, una historia de caminar descalzos, una herida que llega hasta el hueso, amputación previa de una extremidad inferior y pérdida de la sensibilidad protectora16.
El sistema de clasificación de la úlcera de pie diabético de Wagner, de 0 a 5, se usa habitualmente para clasificar las DFU según la profundidad de la úlcera y la presencia de infección. Las DFU que tienen abscesos, septisemias articulares u osteomielitis generalmente son úlceras profundas que se clasifican como de grado 3 de acuerdo con el sistema de clasificación de úlcera de pie diabético de Wagner16,19.
El método actual en el tratamiento de pacientes con DM se enfoca especialmente en la prevención de la formación o recurrencia de las DFU3 y de las amputaciones de extremidades inferiores (LEA, por sus siglas en inglés). El cuidado preventivo multidisciplinario en la DFU está destinado al tratamiento conservador que es menos costoso si se lo compara con los costos de amputación pagados por los pacientes y los servicios de salud20. Además, los prestadores de asistencia médica deben apuntar a mejorar la calidad de vida de los pacientes con DFU, que es baja en este grupo de pacientes21.
Estudio de caso
Descripción del paciente y presentación de la queja
El Sr. MM, hombre de 59 años de edad, fue derivado del consultorio de la empresa a nuestro hospital con una DM no controlada, pérdida gradual de la visión y una callosidad hemorrágica en el dedo gordo del pie izquierdo.
Al presentarse en el consultorio de DM del Moi Teaching and Referral Hospital, la pierna izquierda del Sr. MM estaba edematosa (Figura 1) y la callosidad hemorrágica (Figura 2) en la articulación metatarsofalángica del dedo gordo era claramente visible. Su historia clínica indicaba que él había tenido DM desde 1996, había sufrido de hipertensión en 2000 y fue tratado por celulitis, que se curó bien, en el dedo gordo del pie derecho en agosto de 2017. Sus medicaciones incluían insulina Mixtard, 20 unidades internacionales por la mañana y 10 unidades internacionales por la noche. El Sr. MM no había podido controlar los niveles de glucemia (BSL) y la glucemia en ayunas ahora variaba entre 20 y 22 mmol.
El Sr. MM aún no había notado nada con respecto al pie o al dedo del pie hasta que se tornó muy doloroso y le pidió a su hijo que le controlara los pies. Pensó que el problema se debía al mal calzado, que había estado usando durante un tiempo. No informó historia de traumatismo; sin embargo, tenía poca sensibilidad en el área del pie. Tenía poco apetito y había bajado de peso, de 150 kg a 140 kg. Su visión se había deteriorado al grado en que él no podía leer el periódico.
En su visita inicial al consultorio para el cuidado de heridas, lo trajeron en silla de ruedas y se veía deprimido. Él declaró que si tenían que hacerle una amputación, no podría usar muletas debido a su visión deficiente y a su mayor peso corporal.
Intervenciones y plan de tratamiento de heridas
Evaluación de los pies
En la palpación, no tenía pulso ni en el dorsalis pedis ni en el [tendón] tibial posterior de la pierna izquierda, pero se podía palpar bien en la pierna derecha.
Su ABI estaba a 0,92 con una presión sistólica del tobillo de 168 mmHg y una presión sistólica en el brazo de 154 mmHg. La autoevaluación del cuidado del pie indicaba que el Sr. MM necesitaba asistencia debido a su debilidad corporal, visión deficiente y a no poder llegar hasta los pies. La información sanitaria sobre los efectos de la DM en el pie, entre otras partes del cuerpo, se le dio al hijo y al cuñado, quienes lo acompañaban, incluso la observación con luz con respecto a cualquier anormalidad/deformidad.
Se detectó la pérdida de sensibilidad tocándole el pie en diferentes partes con los ojos cerrados, dado que ni los monofilamentos de Semmes Weinstein ni la máquina Doppler estaban disponibles en el consultorio de cuidado de heridas. El tiempo de rellenado capilar del Sr. MM de los dedos del pie era de 4–5 segundos; sin embargo, el Sr. MM no presentaba sensibilidad asociada cuando se llevó a cabo la evaluación.
Desbridamiento de la herida
Durante la visita inicial del Sr. MM al consultorio de DM se realizó el desbridamiento de la callosidad debajo de la articulación metatarsofalángica del dedo gordo. Después del desbridamiento inicial de la callosidad, la herida se clasificó como DFU de grado 2, utilizando el sistema de clasificación de úlcera de pie diabético de Wagner (Figura 3).
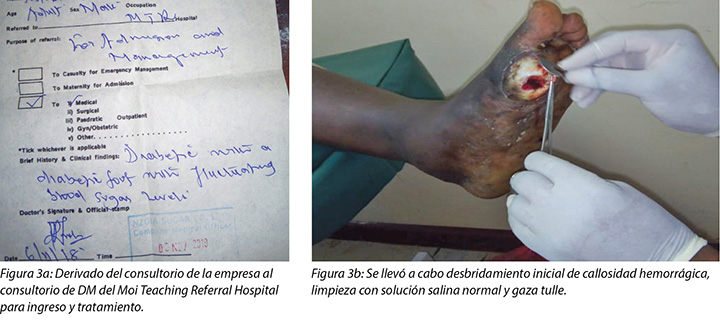
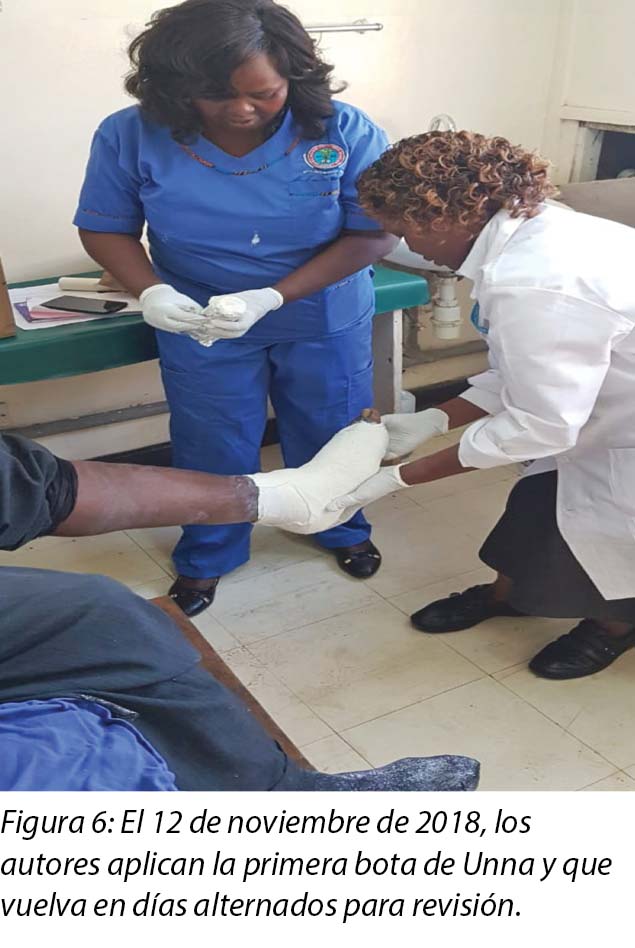
En la primera visita al consultorio de cuidado de heridas del 12 de noviembre de 2018, se llevó a cabo la evaluación de la herida, la limpieza con agua tibia, el desbridamiento repetido y la aplicación de dos partes de óxido de zinc, fabricado localmente, y una bota de Unna (Figuras 4, 5 y 6), y se le recomendó al Sr. MM que regrese en dos días.
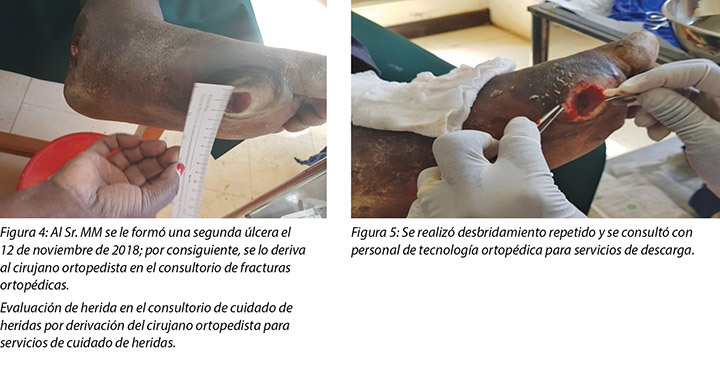
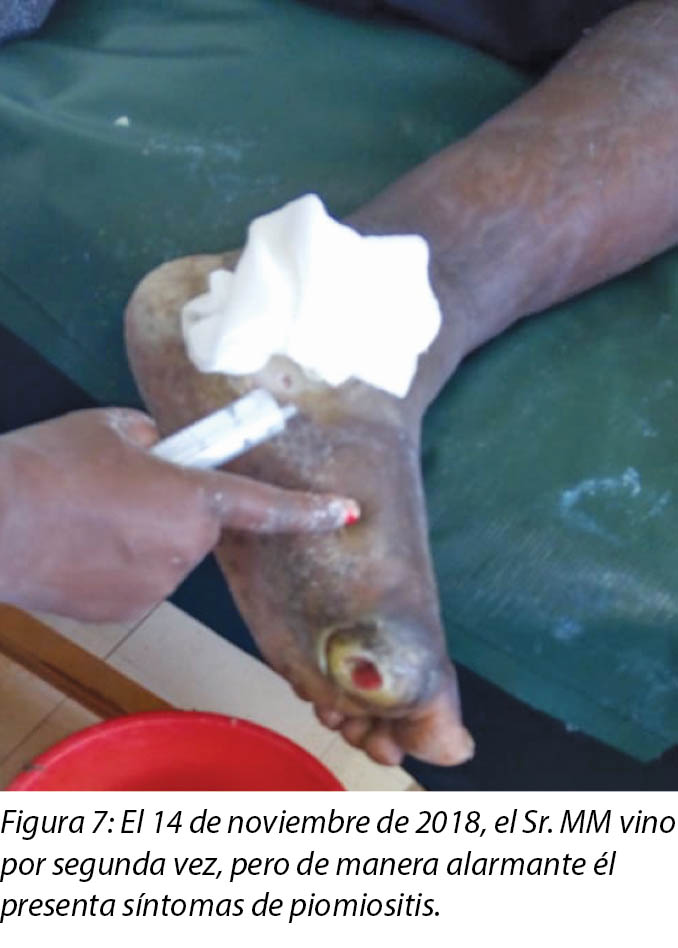
En la segunda visita del 14 de noviembre de 2018 (Figura 7), se observó que el pie del Sr. MM estaba muy tibio y que tenía una hinchazón localizada y edema con fóvea. En esta instancia se le debía realizar una segunda aplicación de la bota de Unna, que se había programado en días alternados después de la primera aplicación. Se llegó al diagnóstico clínico de piomiositis sobre la base de los signos y síntomas presentes en el pie, que se debían a la presencia de un absceso y edema localizado. A la palpación, el pie afectado se sentía caliente con una temperatura corporal de 37,8 °C constatada por medio del uso del termómetro clínico infrarrojo. El Sr. MM apenas podía mover todos los dedos del pie izquierdo, incluso con un rango pequeño de dorsiflexión y de flexión plantar de acuerdo con las instrucciones.
En el consultorio se llevó a cabo una incisión local y drenaje de la piomiositis, así como también un desbridamiento intenso del tejido necrótico y de la callosidad residual en la periferia de la herida. Se comenzó un tratamiento con antibióticos con un ciclo de clindamicina para combatir la infección asociada con la piomiositis. Se le dio 1 gramo por vía oral cada 8 horas durante 7 días. Lamentablemente, no se pudo obtener en ese momento un hisopado de pus para cultivo y sensibilidad a fin de identificar el agente causal específico (Figuras 8 –11). La nueva clasificación de la DFU del Sr. MM era de grado 3 en la clasificación de úlcera de pie diabético de Wagner, porque se había transformado en una úlcera profunda con absceso.
El 5 de noviembre de 2018, el Sr. MM notó la primera herida, que era indolora con callosidad hemorrágica (Figura 2); por consiguiente, fue al consultorio de la empresa el 6 de noviembre de 2018. Se le recomendó que venga a nuestro hospital para otro tratamiento, pero solo fue al consultorio de DM el 10 de noviembre de 2018. Se llevó a cabo desbridamiento de la callosidad hemorrágica y clasificación de la primera herida (Figura 3a y b).
La segunda herida se observó el 12 de noviembre de 2018 cuando fue para un examen en el consultorio de DM, según recomendación, y allí fue cuando se lo derivó al médico ortopédico en el consultorio traumatológico para otra evaluación. Fue en este momento en el que el cirujano ortopedista, después del examen, le recomendó al paciente que vaya al consultorio de cuidado de heridas para los servicios de cuidado de heridas.
La tercera herida se formó el 14 de noviembre de 2018 por una incisión y drenaje del pus debido a la piomiocitis, que se observó al examinar la herida antes de realizar la limpieza (Figuras 7 y 8). Se observó que las tres heridas estaban relacionadas cuando se extrajo el pus con la jeringa durante el desbridamiento (Figura 9).
Tratamiento de las heridas
En el consultorio de DM, inicialmente la herida se había limpiado con solución salina normal, se había realizado el desbridamiento mediante un bisturí y pinzas de forcipresión arterial y colocado apósitos de gasa con SufraTulle.
En el consultorio de cuidado de heridas, la limpieza de la herida se realizó con agua tibia del grifo, el desbridamiento intenso seriado se realizó utilizando un bisturí y pinzas de forcipresión arterial/disección sin anestesia ni analgésicos, dado que el Sr. MM no sentía dolor alguno; además se le colocó un vendaje con dos partes de óxido de zinc, fabricado localmente.
Dado que el Sr. MM tenía un grado de edema en la extremidad inferior izquierda (Figura 1) que indicaba estásis circulatoria, fue necesario el uso de una leve compresión durante el período inicial de la aplicación del vendaje de bota de Unna. Finalmente, una vez que disminuyó el edema se detuvo la compresión con el vendaje.
En cada cambio de vendaje posterior se realizó un desbridamiento de la herida, según fuera necesario, y se le colocó un vendaje con óxido de zinc, fabricado localmente (bota de Unna). La primera bota de Unna se aplicó el 12 de noviembre de 2018 después del desbridamiento repetido (Figuras 5 y 6). El segundo cambio de vendaje con la bota de Unna se llevó a cabo el 14 de noviembre de 2018 después de la incisión y el drenaje. El tercer cambio de vendaje de bota de Unna se realizó el 16 de noviembre de 2018 y, a partir de ese momento, se continuó el tratamiento todos los lunes y viernes como paciente externo por un período de dos meses. La frecuencia del desbridamiento con desbridamiento [sic] se realizó todos los lunes y, durante todo el tercer mes lo realizó el hijo, dado que le enseñamos cómo llevar a cabo el cambio de vendajes en casa. De ahí en adelante, él cambiaría el vendaje los lunes y vendría al consultorio cada quince días para que nosotros evaluemos al paciente y la herida, así como también para evaluar su destreza para cambiar el vendaje. Este régimen se continuó con el vendaje con óxido de zinc, fabricado localmente -bota de Unna- como vendaje primario en el consultorio y en la casa hasta completar la cicatrización de las tres heridas, lo que se logró el 17 de marzo de 2019 después de un período de cuatro meses.
Enfoque multidisciplinario
El tratamiento de las DFU del Sr. MM fue complejo y requirió el enfoque de un equipo multidisciplinario para orientarlo con respecto a su cuidado.
Cirujano ortopedista
La primera visita del Sr. MM y el desbridamiento de la callosidad hemorrágica fue el 10 de noviembre de 2018. La segunda úlcera se formó o se observó el 12 de noviembre de 2018 cuando el Sr. MM vino al consultorio de DM por segunda vez, después de la derivación del cirujano ortopedista. El cirujano ortopedista evaluó el pulso del pie en el músculo dorsalis pedis y en el tendón tibial posterior/anterior e indicó radiografías del pie. Al analizar el informe de la radiografía, derivó al paciente a los servicios de cuidados de heridas, dado que el hueso no estaba comprometido.
Posteriormente, el 14 de noviembre de 2018, se le diagnosticó la piomiositis, que derivó en la formación de la tercera herida con una incisión y drenaje practicados por personal clínico matriculado especializado en ortopedia (Figuras 8 y 9a). En ese momento no fue posible la participación del cirujano ortopedista, pero el personal clínico también especializado en ortopedia trabajó estrechamente con el cirujano ortopedista, quien completó la incisión y el drenaje, y también recetó clindamicina de 1 g por vía oral, cada ocho horas durante 7 días.
Técnico ortopédico: pie y descarga de presión
La descarga de presión del pie afectado resultó una intervención clave en el tratamiento de las DFU del Sr. MM. Fue examinado por un técnico ortopédico y se lo asesoró sobre los beneficios de la descarga, así como también sobre los cambios necesarios en el calzado. De acuerdo con el asesoramiento del técnico ortopédico, se cambiaron sus zapatos por otros acolchados, en lugar de unos cerrados.
Especialista en nutrición
Un especialista en nutrición, un educador en materia de diabetes y el personal de enfermería asesoraron al Sr. MM y a sus parientes sobre los requisitos alimentarios, el control del BSL y la educación de la salud en general, incluso con respecto a la examinación diaria del pie y su cuidado.
Apoyo psicológico
A veces, las DFU mostraban síntomas de estancamiento en la cicatrización de la herida cuando no había cambios en el estado de la herida (Figura 12). En esas instancias, se le ofreció al Sr. MM apoyo psicológico y terapéutico, dado que esto ocurría a menudo con heridas de esta naturaleza. Se lo alentó a seguir con todos los aspectos de sus regímenes de tratamiento.
Planificación del alta, cuidado comunitario y seguimiento a largo plazo
El Sr. MM, la esposa de MM y el hijo llevaron a cabo una sesión de terapia familiar sobre el cuidado de la herida en casa, el régimen alimentario, el examen del pie y el monitoreo del BSL. Se enfatizó sobre la importancia de la participación activa del Sr. Mr MM en su autocuidado, cuando fuera posible, para evitar el deterioro o recurrencia de su DFU y para mejorar su bienestar general.
Se les enseñó a la esposa y al hijo del Sr. MM a examinar la herida, a controlar los síntomas preulcerativos en el pie y a aplicar el vendaje de herida de bota de Unna (Figura 13a y 13b). También se le explicó cómo reconocer un calzado apretado o inadecuado, dado que el uso de calzado adecuado es un factor clave para prevenir la recurrencia de DFU.
El Sr. MM compró un glucómetro para monitorear en casa los BSL en ayunas, que se habían estabilizado en 6–8 mmol/L.
Discusión
La mayoría de los pacientes con DM padecerán una DFU en algún momento de su vida22. Las DFU son una causa de alta morbilidad y mortalidad que también provocan costos financieros importantes 23.
La neuropatía diabética provoca fallas en la sensibilidad al dolor debido a la pérdida de percepción sensorial en el pie; es por eso que los pacientes con neuropatía diabética no buscan ayuda inmediatamente. Los pies insensibles son susceptibles de sufrir mayor resquebrajamiento y presión en las superficies plantares o en la planta del pie y, en consecuencia, tienen mayores lesiones24. La neuropatía motora provoca una extenuación de los músculos intrínsecos del pie mientras que la neuropatía autonómica afecta la sudoración con sequedad y la descamación de los pies. Estos fenómenos llevan a la formación de úlceras, deformidades del pie y problemas en la movilidad de las articulaciones.
El tratamiento de los pacientes con DFU es, lamentablemente, implementado con frecuencia por prestadores de asistencia médica cuyos conocimientos existentes y opiniones con respecto a los factores causales, diagnóstico y tratamiento de las DFU son deficientes. Incluso, en los países desarrollados, los especialistas en diabetes derivan a los pacientes a los servicios de enfermería comunitarios donde el personal de enfermería carece del conocimiento necesario y de la competencia clínica para tratar dichas heridas de manera competente25. Dado que es un problema multifacético, los protocolos basados en las pruebas, el fortalecimiento de un equipo multidisciplinario y los regímenes clínicos en instalaciones específicas para la asistencia médica logran mejores resultados. Se encontró que los programas de cuidado del pie basados en personal de enfermería son efectivos para la prevención de las DFU26.
El personal de enfermería es responsable del tratamiento de las DFU derivadas a los servicios de cuidado de heridas en el Moi Teaching and Referral Hospital de Kenia. La administración del hospital ha posibilitado que un cirujano ortopedista, dos enfermeros, un funcionario clínico registrado, un fisioterapeuta y un terapeuta ocupacional llevaran a cabo el curso de cuidado de heridas IIWCC en la Stellenbosch University RSA desde 2010 a la fecha.
Diabetes Kenya, anteriormente llamada Asociación para la Diabetes de Kenia (Kenya Diabetes Association), trabaja estrechamente con la Federación Internacional para la Diabetes (International Diabetes Federation) para posibilitar la formación de educadores multidisciplinarios especializados en materia de diabetes en nuestro hospital que, en la actualidad, cuenta con seis personas (tres enfermeros, un funcionario clínico matriculado y dos médicos). Estos equipos (heridas/diabetes) organizan cursos de formación en el hospital para otro personal del hospital, así como también asiste a conferencias y seminarios nacionales, cuando es posible, para aumentar el conocimiento y la práctica dirigida al desarrollo de una comunidad entusiasta con respecto a la práctica en heridas en el hospital.
Al Sr. MM se lo derivó del consultorio de la empresa, a más de 100 kilómetros de distancia, debido a la falta de prestadores de asistencia médica que se sintieran cómodos para tratar su DFU.
El tratamiento de las DFU a menudo es complejo y requiere un enfoque multidisciplinario para lograr resultados óptimos para el paciente. El equipo multidisciplinario puede: reducir la incidencia de las complicaciones de la DFU y la gravedad relacionada con estas complicaciones; reducir las amputaciones; mejorar la calidad de vida de un paciente; y aumentar su esperanza de vida22. En este caso, la opinión clínica del cirujano ortopedista, del técnico ortopédico, del especialista en nutrición, del terapeuta y del personal de enfermería junto con la familia del Sr. MM pudo salvar el pie del Sr. MM, facilitar la cicatrización de la herida y evitar la amputación de parte o de todo el pie. Las intervenciones clave en el tratamiento de las heridas del Sr. MM fueron el desbridamiento de la herida, el cuidado local de la herida, la descarga de presión y la estabilización de los BLS del Sr. MM, la educación del paciente y el apoyo psicológico.
El desbridamiento de la herida del tejido tórpido y desvitalizado para exponer el tejido sano y sangrante permite una mejor visualización del grado de la úlcera y de la presencia de abscesos o fístulas permanentes27,28. Además, disminuye el riesgo de diseminar la infección y reduce la presión en la periferia de la herida debido a la presencia de callosidad; todo esto aumenta la contracción normal de la herida y la cicatrización29. De los pacientes con DFU, se estima que un 20 % tienen infecciones de moderadas a graves que requieren de amputación a un cierto nivel30,31. Por consiguiente, en cada cambio de vendaje se llevó a cabo un desbridamiento intenso y conservador de la herida.
El régimen de cuidado de la herida consistía en la limpieza con agua tibia del grifo, el desbridamiento agudo con bisturí y pinzas de forcipresión arterial/disección, la inyección con solución salina normal usando una jeringa de 20 cc y la aplicación de un vendaje primario con óxido de zinc con apósito grande de 6 pulg. para el vendaje externo.
La frecuencia del desbridamiento seriado y el cambio de vendaje se realizó inicialmente en días alternados durante la primera semana debido a la infección, luego todos los lunes y viernes (dos veces por semana) y, de ahí en adelante, todos los lunes (una vez por semana), pero el hijo lo hacía en la casa una vez por semana, después el Sr. MM venía al consultorio quincenalmente durante el cuarto mes del cuidado de la herida.
La aplicación de un vendaje con óxido de zinc, fabricado localmente (bota de Unna) junto con los principios clave básicos del cuidado de heridas se utilizó durante un período de cuatro meses para facilitar la cicatrización de las heridas. Se cree que el óxido de zinc en el vendaje disminuye la inflamación, protege la piel circundante, aumenta la reepitelización y reduce el edema. El vendaje de óxido de zinc en forma de bota de Unna se seca y forma una bota ajustada y cálida alrededor de la extremidad inferior que mantiene el retorno venoso provocando alta presión con contracción muscular cuando el paciente camina, pero poca presión cuando está en reposo, lo que ayuda a la cicatrización de la úlcera.
Si bien los pacientes aceptan este vendaje, es imperioso que el personal esté capacitado en la evaluación correcta del pie y de la herida, y en la aplicación de este vendaje para evitar la contracción de la extremidad y la oclusión arterial en presencia de neuropatía32,34. Es importante evaluar el flujo vascular junto con el músculo dorsalis pedis y la arteria tibial posterior29 antes de aplicar cualquier compresión al miembro inferior. Se informó que el Sr. MM se sentía más seguro y con confianza con la pierna izquierda después de la aplicación de la bota de Unna.
Idealmente, el tratamiento de las DFU requiere que la persona no cargue peso en el área afectada para mejorar la cicatrización. Hay una gran variedad de estrategias para descargar la presión de las DFU, que incluye calzado ortopédico comercial, calzado personalizado que incluye plantillas, férulas de contacto y acolchado externo que se puede moldear para adaptarlo al contorno del pie. El tipo de descarga usado depende del paciente y de los factores ambientales, el acceso y el costo del calzado ortopédico35,36. Teniendo en cuenta estos factores y para facilitar la descarga en la úlcera del Sr. MM, el técnico ortopédico recomendó el uso de zapatos abiertos con acolchado. El técnico ortopédico no colocó ningún acolchado adicional en el pie del Sr. MM, pero recomendó zapatos con acolchado más grandes y abiertos para aliviar la presión de las heridas. Le explicó que los zapatos que estaba usando el Sr. MM eran ajustados con hebillas y lazos, y sin acolchado, que causaron la formación de la segunda herida.
Las DFU afectan de manera grave la calidad de vida relacionada con la salud debido a la poca posibilidad de realizar las actividades físicas de la vida cotidiana, hecho que afecta el bienestar psicológico y social. Esto puede derivar en un aislamiento social en general, en tensión que afecta negativamente las relaciones familiares, en dificultades financieras debido a la pérdida de productividad o del trabajo y en estrés emocional y depresión en personas con DFU37. No obstante, estos factores están influenciados por las características clínicas personales del paciente, que incluyen factores demográficos, sociales y ambientales38.
El autocuidado es un factor fundamental para lograr la salud óptima y el tratamiento de la DM. Esto se puede lograr de manera eficaz mediante el uso de las teorías y modelos de enfermería, tales como el modelo de autocuidado de Orem38. En Borji et al. se explica que: “Se considera que el autocuidado es un principio importante y valioso porque pone énfasis en el papel activo de las personas con respecto a su propio cuidado de la salud, y no en un papel pasivo”. Además, “la conducta con respecto al autocuidado está afectada por las aptitudes totales y el conocimiento que tiene una persona (o sus parientes), y por adoptar medidas prácticas”, para modificar los factores que afectan la salud y el bienestar de una persona39.
En consecuencia, los enfermeros desempeñan un papel clave en la educación del paciente y de la familia, ayudando a los pacientes y sus familiares a comprender las causas subyacentes de la DM y de la DFU. Este conocimiento le permite a los pacientes y a sus familias desempeñar un papel activo para resolver problemas y tomar decisiones con respecto a su cuidado clínico y psicológico40,41.
Instruir al Sr. MM y a su familia con respecto a su dieta y a la importancia de la dieta, y del ejercicio para ayudar a estabilizar su DM y los BSL fue un ejemplo de autocuidado mediante el cual el Sr. MM pudo participar activamente en su cuidado.
El personal de enfermería también impartió educación clínica a la esposa y al hijo del Sr. MM para tratar sus heridas y el cuidado del pie en casa. Esto incluyó la colocación del vendaje de bota de Unna (Figuras 13a y 13b) en casa.
Dado que hay una gran posibilidad de que se forme una nueva úlcera después de un tratamiento exitoso de una DFU en el mismo lugar o en un sitio diferente de la misma extremidad o en la extremidad contralateral42, se ha mantenido un seguimiento del Sr. MM como paciente externo para garantizar que no vuelva a tener una DFU, hecho que es muy importante.
En la actualidad, las variantes de las complicaciones del pie diabético son más frecuentes. Esto se debe a la incidencia global de la DM, así como también a la mayor esperanza de vida lograda por mejores tratamientos. Esto requiere un cambio en el paradigma de los prestadores de atención de la DM que se enfocan en las tendencias actuales y emergentes para la prevención, el diagnóstico y el tratamiento de la DFU, entre otras complicaciones del pie diabético27. Por consiguiente, es necesario enfocar la educación en la DM y en el tratamiento de las heridas diabéticas tanto hacia los profesionales de la salud como hacia los pacientes porque los prestadores de asistencia médica y los profesionales de la salud pueden contribuir al desarrollo, así como también al deterioro de la DFU43. El aumento de la DM y de las DFU requieren, a nivel global, la atención de todos los profesionales de la salud y, específicamente, la adopción de un abordaje realizado por un equipo multidisciplinario eficaz para el diagnóstico y el tratamiento, incluso con la participación del paciente y del personal de enfermería44.
Conclusión
La incidencia de la DM y de las DFU está aumentando en todo el mundo. No todos los prestadores de asistencia médica y los profesionales de la salud están lo suficientemente educados para evaluar y tratar las DFU. La derivación de los pacientes con DFU a los consultorios de asistencia médica con experiencia en la evaluación y el tratamiento de las DFU es crítica para lograr un resultado exitoso para el paciente y para el prestador de asistencia médica.
La derivación del Sr. MM a nuestro hospital, donde se adoptó un enfoque multidisciplinario para su DFU, facilitó la cicatrización de la herida, salvó la extremidad y previno una amputación innecesaria de la parte inferior de la pierna izquierda lo que, sin duda, mejoró su calidad general de vida.
Los enfermeros con experiencia en el tratamiento de las heridas aplicaron la teoría del autocuidado para educar al Sr. MM y a su familia con respecto a su DM, al control y monitoreo del BSL, al cuidado de sus heridas y al cuidado de los pies dentro del ámbito del consultorio y de la comunidad.
Agradecimientos
Deseamos agradecer a la Dra. Aileen Chang de la University of California y académica invitada de la Moi University/Ampath Eldoret, por su ayuda al escribir este texto.
Conflicto de intereses
Los autores declaran que no hay conflictos de intereses.
Financiación
Los autores no recibieron financiación para este estudio.
Author(s)
Margaret Mungai
MBA-Strategic Mgt, IIWCC,BSC N
Moi Teaching & Referral Hospital
Eldoret, Kenya (East Africa)
Deputy Director Nursing-Clinical Services
Moi Teaching and Referral Hospital in Eldoret Kenya
Emmy Sirmah
Wound Care Nurse
Wound Care Services Clinic
Moi Teaching and Referral Hospital Eldoret, Kenya
Correspondence to Margaret Mungai
Email margiemungai@gmail.com/margaretmungai@mtrh.go.ke
References
- World Health Organization (WHO). Global Health Estimates: Death by cause, Age, Sex and County 2000–2012. Geneva: WHO; 2014.
- World Health Organization (WHO). World Health Day 2016: Beat Diabetes.
- Armstrong DG, Boulton AJM & Bus SA. Diabetic foot ulcers and their recurrence. New Engl J Med 2017; 376(24):2367–2375. https://doi.org/10.1056/NEJMra1615439
- Boulton AJM. The diabetic foot: grand overview, epidemiology and pathogenesis. Diabetes Metab Res Rev 2008; 24(Suppl 1):S3–6. doi: 10.1002/dmrr.833.
- International Diabetes Federation (IDF). Diabetes Atlas, 7th edn. IDF; 2015.
- Mohamed SF, Mwangi M, Mutua MK et al. Prevalence and factors associated with pre-diabetes and diabetes mellitus in Kenya: results from a national survey. BMC Public Health 2018; 18(Suppl 3):1215. https://doi.org/10.1186/s12889-018-6053-x
- IWGDF Editorial Board. IWGDF Definitions and Criteria. IWGDF; 2019. Available at: https://iwgdfguidelines.org/definitions-criteria/. Accessed 04/23, 2019.
- Nyamu PN, Otieno CF, Amayo EO & McLigeyo SO. Risk factors and prevalence of diabetic foot ulcers at Kenyatta National Hospital, Nairobi. East Afr Med J 2003 Jan; 80(1):36–43.
- Waaijman R, de Haart M, Arts ML et al. Risk factors for plantar foot ulcer recurrence in neuropathic diabetic patients. Diabetes Care 2014; 37(6):1697–705. doi: 10.2337/dc13-2470.
- Cutting KE & Harding KG. Criteria for identifying wound infection. J Wound Care 1994; 3(4):198–201.
- Kibachio JM, Omolo J, Muriuki Z et al. Risk factors for diabetic foot ulcers in type 2 diabetes: a case control study, Nyeri, Kenya. African Journal of Diabetes Medicine 2103; 21(1):20–23.
- McNeely MJ, Boyko EJ, Ahroni JH et al. The independent contributions of diabetic neuropathy and vasculopathy in foot ulceration. How great are the risks? Diabetes Care 1995; 18(2):216–19.
- Prompers L, Hujberts M, Apelqvist J et al. High prevalence of ischaemia, infection and serious comorbidity in patients with diabetic foot disease in Europe. Baseline results from the Eurodiale study Diabetologia 2007; 50(1):18–25.
- Bronze MS & Khardori R. Diabetic Foot Infections. https://emedicine.medscape.com/article/237378-overview2019.
- Seah MYY, Anavekar SN, Savige A & Burrell LL. Diabetic pyomyositis: An uncommon cause of a painful leg. Diabetes Care 2004; 27(7):
- Lipsky BA, Berendt AR, Cornia PB et al. 2012 Infectious Diseases Society of America Clinical Practice Guideline for the Diagnosis and Treatment of Diabetic Foot Infections. Clin Infect Dis 2012; 54(12):132–173.
- Gemechu FW, Seemant FNU & Curley CA. Diabetic foot infections. Am Fam Physician 2013; 88(3):177–184.
- World Union of Wound Healing Societies (WUWHS). Florence Congress, Position Document. Advances in wound care: the Triangle of Wound Assessment Wounds International. WUWHS; 2016.
- Varnado M. Lower Extremity Neuropathic Disease. In: Core Curriculum Wound Management. Doughty DB & McNichol LL, eds. Philadelphia: Wolters Kluwer; 2016.
- Apelqvist JG. Ragnarson–Tennvall G, Lairsson J & Persson U. Diabetic foot ulcers in a multidisciplinary setting. An economic analysis of primary healing and healing with amputation. J Intern Med 1994; 235(5):463–467.
- Khunkaew S, Fernadez R & Sim J. Health-related quality of life among adults living with diabetic foot ulcers: a meta analysis. J Qual Life Res 2019 Jun; 28(6):1413–1427. doi: 10.1007/s11136-018-2082-2
- Yazdanpanah L, Nasiri M & Adarvishi S. Literature review on the management of diabetic foot ulcers. World J Diabetes 2015; 15;6(1):37–53.
- American Diabetes Association. Standards of Medical Care in Diabetes 2016. In: Diabetes Care 2016; 39(Suppl 1).
- Lavery LA, McGuire JB, Baranoski S, Ayello EA & Kravitz SR. Diabetic Foot Ulcers. In: Baranoski S & Ayello EA, eds. Wound Care Essentials Practice Principles, 2nd edn. Philadelphia: Williams & Wilkins; 2008.
- Schaarup C, Pape-Haugaard L, Jensen MH, Laursen AC, Bermark S & Hejlesen OK. Probing community nurses’ professional basis: a situational case study in diabetic foot ulcer treatment. Br J Comm Nurs 2017; 22(Suppl 3):S46–S52. https://doi.org/10.12968/bjcn.2017.22.Sup3.S46
- Fujiwara Y, Kishida K, Terao M et al. Beneficial effects of foot care nursing for people with diabetes mellitus; an uncontrolled before and after intervention study. J Adv Nurs 2011; 67(9):1952–1962.
- Uçkay I, Aragón-Sánchez J, Lew D & Lipsky BA. Diabetic foot infections: what have we learned in the last 30 years? Int J Infect Dis 2015; 40:81-91. doi: 10.1016/j.ijid.2015.09.023.
- Frykberg RG, Armstrong DG, Giurini J et al. Diabetic foot disorders: a clinical practice guideline. American College of Foot and Ankle Surgeons. J Foot Ankle Surg 2000; 39(Suppl 5):S1–60.
- Kruse I & Edelvan S. Evaluation and treatment of diabetic foot ulcers. Clin Diabetes 2006; 24(2):91–93.
- Lipsky BA, Berendt AR, Cornia PB et al. 2012 Infectious Diseases Society of America Clinical Practice Guideline for the Diagnosis and Treatment of Diabetic Foot Infections. Clin Infect Dis 2012; 54:e132–e173.
- Lavery LA, Armstrong DG, Wunderlich RP, Tredwell J & Boulton AJ. Diabetic foot syndrome: evaluating the prevalence and incidence of foot pathology in Mexican Americans and non-Hispanic whites from a diabetes disease management cohort. Diabetes Care 2003; 26:1435–1438.
- Fonder MA, Lazarus GS, Cowan DA et al. Treating the chronic wound: A practical approach to the care of non-healing wounds and wound care dressings. J Am Acad Dermatol 2008; 58(2):185–206.
- Luz BSR, Araujo SC, Novato Castelli Von Atzingen DA & Rodrigues dos Anjos Mendonça A. Evaluating the effectiveness of the customized Unna boot when treating patients with venous ulcers. An Bras Dermatol 2013; 88(1):41–9.
- Matos de Abreu A & Guitton Renaud Baptista de Oliveira B. A study of the Unna Boot compared with the elastic bandage in venous ulcers: a randomized clinical trial1. Rev Latino-Am Enfermagem 2015 July–Aug; 23(4):571–7 DOI: 10.1590/0104-1169.0373.2590
- American Diabetes Association. Microvascular complications and foot care. Sec. 9. In Standards of Medical Care in Diabetes 2016. Diabetes Care 2016; 39(Suppl 1):S72–S80.
- van Netten J, Lazzarini PA, Armstrong DG et al. Journal of Foot and Ankle Research (2018) 11:2 doi: 10.1186/s13047-017-0244-z
- Goodridge D, Trepman E & Embil JM. Health-related quality of life in Diabetic patients with foot ulcers: Literature review. J Wound Ostomy and Continence Nursing 2005; 32(6):368-377.
- Nemora J, Hlinskova E, Farsky I et al. Quality of life in patients with diabetic foot ulcer in Visegrad countries. J Clin Nurs 2017; 26(9–10):1245–1256.
- Borji M, Otaghi M & Kazembeigi S. The impact of Orem’s Self-care Model on the quality of life in patients with type ii diabetes. Biomedical & Pharmacology Journal 2017; 10(1):213–220.
- Aalaa M, Tabatabaei Malazy O, Sanjari M et al. J Diabetes Metab Disord 2012; 11:24. http://www.jdmdonline.com/content/11/1/24
- Ghafourifard M & Ebrahimi H. The effect of Orem’s self-care model-based Training on self-care agency in Diabetic patients. Scientific Journal of Hamadan Nursing and Midwifery Faculty 2015; 2(1):5–13.
- Orneholm H, Apelqrist J, Larsson J & Eneroth M. Recurrent and other new foot ulcers after healed plantar fore foot diabetic ulcer. Int J Tiss Rep Regen 2017; 25(2):309–315.
- Macfarlane RM & Jeffcoate WJ. Factors contributing to the presentation of diabetic foot ulcers. Diabet Med 2004; 14 (10):867–870.
- Sibbald GR, Ayello EA, Eliot J, Smart H & Stelton S. 2016 Cape Town declarations of action on diabetic foot ulcers and insulin access. WCET Journal 2016; 36(2):30–37.



