Volume 42 Number 4
Statistical testing in wound care
John Stephenson
Keywords inferential statistical tests, p value, confidence intervals, odds ratio
For referencing Stephenson J. Statistical testing in wound care. WCET® Journal 2022;42(4):38-40
DOI
https://doi.org/10.33235/wcet.42.4.38-40
Submitted 6 November 2022
Accepted 1 December 2022
Wound care studies generally yield quantitative data; and that data require some form of analysis. Almost all studies include a descriptive summary of participants, as discussed in my previous article1. However, many studies also require some form of inferential statistical testing; usually if the intention is to generalise findings from the sample to a population.
Different study designs require different testing methods, although the basic aim in most cases is the same. This is to assess the significance of the effect of interest; that is, to establish whether any effect we see in our sample data is a reflection of the state of affairs in the parent population, or likely to be nothing more than random variation in our data. An effect could be an observed difference between study groups (such as amount of biofilm present in a control group and a group where patients are treated with an anti-microbial dressing), the difference between a measure taken at baseline and post-intervention from a single patient group (such as pain levels during and after surgery), an observed relationship between two variables (such as the extent of mobile health technology use and wound care knowledge) or many other quantities.
Establishment of statistical significance requires a test of a hypothesis. We usually test a null hypothesis (of no effect); for example, that the difference in means in the population is zero. Miller et al2 conducted a pilot single-blinded randomised controlled trial (RCT) to examine concordance with and acceptability of electric stimulation therapy (EST) in patients with venous leg ulcers (VLUs) who had not tolerated moderate to high compression. The treatment was tested against the null hypothesis of no effect; i.e. that concordance with the total recommended treatment time under control treatment or under EST was the same. Lenselink and Andriessen3 measured (among other quantities) the percentage of granulation tissue and yellow tissue in a cohort study on the efficacy of a polyhexanide-containing biocellulose dressing in 28 patients, testing several hypotheses relating to differences in patient outcomes between baseline and 24 weeks. In a study of diabetic and non-diabetic patients, Gunes et al4 analysed several biomarkers, primarily galectin-3 (which promotes angiogenesis and new vessel formation) and tested several hypotheses relating to relationships between galectin-3 and various other biomarkers.
Significance is quantified using the familiar (if not widely understood) p-value, which is a conditional probability: the probability that observed results, or something more extreme, would have been obtained, given that the null hypothesis is true. In everyday parlance it is referred to loosely as ‘the chance of a chance’: that is, the probability that our data has fallen the way it has just as a result of natural variation and not because an effect actually exists. Conventionally, a p-value below 0.05 (5%) is taken as indicating an outcome of statistical significance (at the 5% significance level) and a consequential rejection of the null hypothesis of no effect. The study of Miller et al yielded a p-value of 0.671 for its primary outcome; indicating insufficient evidence for a difference between treatment groups. The study of Lenselink and Andriessen yielded a p-value reported to be less than 0.04 for a test comparing the mean percentage of granulation tissue from baseline to 24 weeks post-treatment; indicating evidence for a treatment effect. The study of Gunes et al yielded a p-value of less than 0.001 in a test for correlation between the galectin-3 and C-reactive protein biomarkers, indicating strong evidence for a significant relationship between these biomarkers.
The RCT conducted by Miller et al and the test of changes from baseline conducted by Lenselink and Andriessen are examples of grouped study designs: an unpaired study, in which two unrelated study groups are compared, in the case of Miller et al and a paired study design, in which the measures are taken on two occasions from the same group of patients, in the case of Lenselink and Andriessen (the word ‘paired’ refers to the fact that each patient contributes a pair of readings, not that a pair of groups is involved). Another variant of this study arises when measures are taken from patients matched on demographic or health-related variables. The study of Gunes et al is an example of a correlational design using ungrouped data. These three designs are probably the most common choices of study design in wound care, although various other study types, which also aim to infer results from sample data to a population may be found, including for example tests of agreement, screening/diagnostic studies, survival analysis and meta-analysis.
Numerical outcomes in unpaired studies can be compared using the independent samples t-test, or, if more than two groups are involved, a test such as analysis of variance (ANOVA). Categorical outcomes are usually analysed using the chi-squared test for association. For the paired study design, the standard analysis technique is the paired samples t-test or the repeated measures ANOVA. Correlational studies are usually quantified via Pearson’s correlation coefficient, and may be extended into a linear regression setting. All these procedures are parametric procedures which make certain distributional assumptions about the data; if these assumptions are not fulfilled, corresponding non-parametric techniques, such as the rank-sum test, signed ranks test, evaluation of Spearman’s rank correlation coefficient or bootstrapping procedures can often work quite well. All procedures may be easily implemented using standard statistical software and all will yield an assessment of statistical significance as measured by the p-value and given by the software.
While the p-value facilitates an inference of statistical significance or otherwise, it does not give us a measure of precision in our results. This is another side to inferential testing. We may find in our sample an effect of a given size, but it would not be realistic to expect that an effect of precisely that magnitude exists in the wider population. While we will never know what the size of the population effect actually is, it is possible to derive a confidence interval (CI), also known as an uncertainty interval, for it. This is often interpreted loosely as the range of values within which we can state to a certain degree of confidence (conventionally 95%) that a population value lies. More formally, if we were to repeat the procedure many times, then the range of values determined each time would contain the true population parameter on 95% of occasions.
CIs do not quantify the strength of evidence against the null hypothesis, as the p-value does, but instead give a measure of the precision of an estimate (for example, the difference between, or ratio of, the mean values in treatment groups). Nowadays CIs (and the estimate of effect around which they are fitted) are increasingly reported alongside p-values in statistical testing and appear to many to be more informative and easier to understand. While they do not form part of a hypothesis test, most statistical software will automatically report a CI as a by-product of the hypothesis test output.
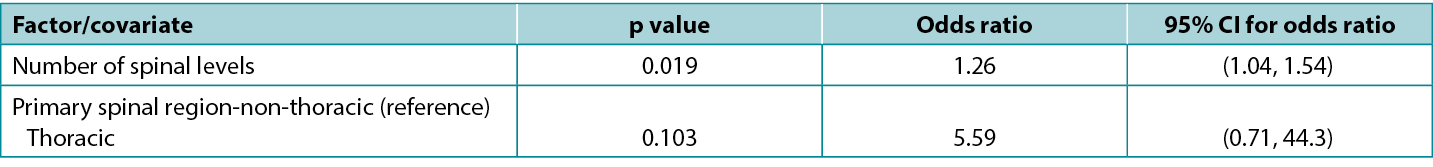
There is an exact correspondence between CIs and the corresponding p-value: a 95% CI that excludes the key value 0 (for a difference between study groups) or 1 (for a ratio between study groups) corresponds to a significant effect at the 5% significance level (i.e. a p-value that is less than 0.05). Conversely, a 95% CI that includes a key value corresponds to a p-value that is statistically non-significant at the 5% significance level (i.e. is 0.05 or greater). Atkinson et al5 investigated the effect of various factors on risk of surgical site infection during spinal surgery and in a typical presentation of tabulated results (below), reported statistics from a model including both p-values and CIs. Note that the spinal levels factor, which is significant according to the p-value (0.019), has an odds ratio with an associated CI of 1.04 to 1.54, which excludes the key value (for a ratio) of 1; while the spinal region factor, which is non-significant according to the p-value (0.103), has an odds ratio with an associated CI of 0.71 to 44.3, which includes the key value. This table is also a good example of how an effect of relatively small magnitude (each additional spinal level is associated with a 26% increase in odds of infection) may be significant; whereas an effect of large magnitude (surgery performed in the thoracic, rather than non-thoracic region is associated with about a fivefold increase in odds of infection) may be non-significant.
Table 1: extract from data table reported by Atkinson et al5
Selection of an appropriate statistical test for a given study design is not always straightforward and requires careful consideration of study parameters. No single test is suitable for all types of studies. For grouped studies, such as the unpaired and paired designs discussed above, we may need to consider, for example, the number of groups, the size of the groups, the distribution of data, the independence of units and the presence or absence of confounding factors in selecting a test. For ungrouped studies, such as correlational studies, we may wish to consider whether our data is in the form of raw data or rank orderings; and for ungrouped studies assessing multiple factors, we may wish to consider whether we are potentially overfitting our data (modelling noise rather than signal) by attempting to analyse too many factors for a sample of a given size.
Special measures are needed for complex designs: for example when data is clustered (such as patients within hospital wards, or anatomical sites within patients); when multiple tests are being conducted (such as may arise in studies with multiple outcome measures, where the key treatment variable has multiple levels, or where separate analyses are conducted on sub-groups of individuals and/or at multiple time points); when outcomes are not known exactly (such as when an outcome is the time to an adverse event in patients who are monitored infrequently); when a series of observations are made on the same patients; or when it is required to determine a synthesised estimate of effect from multiple studies. Certain data features, such as the presence of extensive missing or invalid values or outliers may also lead to a requirement for additional statistical processes. In all such situations it is recommended that the advice of a biomedical statistician is sought.
Pruebas estadísticas en el cuidado de heridas
John Stephenson
DOI: https://doi.org/10.33235/wcet.42.4.38-40
Los estudios sobre el cuidado de heridas suelen arrojar datos cuantitativos; y esos datos requieren algún tipo de análisis. Casi todos los estudios incluyen un resumen descriptivo de los participantes, como ya comenté en mi anterior artículo1. Sin embargo, muchos estudios también requieren algún tipo de pruebas estadísticas inferenciales, normalmente si se pretende generalizar los resultados de la muestra a una población.
Diferentes diseños de estudio requieren diferentes métodos de prueba, aunque el objetivo básico en la mayoría de los casos es el mismo. Se trata de evaluar la importancia del efecto de interés, es decir, determinar si el efecto que observamos en los datos de la muestra es un reflejo de la situación de la población de origen o si es probable que no sea más que una variación aleatoria de los datos. Un efecto puede ser una diferencia observada entre grupos de estudio (como la cantidad de biopelícula presente en un grupo de control y un grupo en el que los pacientes son tratados con un apósito antimicrobiano), la diferencia entre una medida tomada al inicio y después de la intervención de un único grupo de pacientes (como los niveles de dolor durante y después de la cirugía), una relación observada entre dos variables (como el grado de uso de tecnología sanitaria móvil y los conocimientos sobre el cuidado de heridas) o muchas otras cantidades.
El establecimiento de la significación estadística requiere la comprobación de una hipótesis. Normalmente se comprueba una hipótesis nula (de ausencia de efecto); por ejemplo, que la diferencia de medias en la población es cero. Miller et al2 realizaron un ensayo controlado aleatorio (RCT) piloto simple ciego para examinar la concordancia con la terapia de estimulación eléctrica (EST) y su aceptabilidad en pacientes con úlceras venosas de la pierna (VLU) que no habían tolerado una compresión de moderada a alta. El tratamiento se contrastó con la hipótesis nula de ausencia de efecto; es decir, que la concordancia con el tiempo total de tratamiento recomendado bajo tratamiento de control o bajo EST era la misma. Lenselink y Andriessen3 midieron (entre otras cantidades) el porcentaje de tejido de granulación y tejido amarillo en un estudio de cohortes sobre la eficacia de un apósito de biocelulosa con polihexanida en 28 pacientes, poniendo a prueba varias hipótesis relacionadas con las diferencias en los resultados de los pacientes entre el inicio y las 24 semanas. En un estudio de pacientes diabéticos y no diabéticos, Gunes et al4 analizó varios biomarcadores, principalmente la galectina-3 (que promueve la angiogénesis y la formación de nuevos vasos) y probó varias hipótesis relativas a las relaciones entre la galectina-3 y varios otros biomarcadores.
La significación se cuantifica mediante el conocido (aunque no muy comprendido) valor p, que es una probabilidad condicional: la probabilidad de que se hubieran obtenido los resultados observados, o algo más extremo, dado que la hipótesis nula es cierta. En el lenguaje cotidiano, se denomina de forma general " la posibilidad de una oportunidad ": es decir, la probabilidad de que nuestros datos hayan caído de la forma en que lo han hecho sólo como resultado de una variación natural y no porque exista realmente un efecto. Convencionalmente, se considera que un valor p inferior a 0,05 (5%) indica un resultado de significación estadística (al nivel de significación del 5%) y el consiguiente rechazo de la hipótesis nula de ausencia de efecto. El estudio de Miller et al arrojó un valor p de 0,671 para su resultado primario, lo que indica evidencias insuficientes de una diferencia entre los grupos de tratamiento. El estudio de Lenselink y Andriessen arrojó un valor p inferior a 0,04 para una prueba que comparaba el porcentaje medio de tejido de granulación desde el inicio hasta 24 semanas después del tratamiento, lo que indica la existencia de un efecto del tratamiento. El estudio de Gunes et al arrojó un valor p inferior a 0,001 en una prueba de correlación entre los biomarcadores galectina-3 y proteína C reactiva, lo que indica una fuerte evidencia de una relación significativa entre estos biomarcadores.
El RCT realizado por Miller et al y la prueba de cambios con respecto al valor inicial realizada por Lenselink y Andriessen son ejemplos de diseños de estudios agrupados: un estudio no emparejado, en el que se comparan dos grupos de estudio no relacionados, en el caso de Miller et al y un diseño de estudio emparejado , en el que las medidas se toman en dos ocasiones del mismo grupo de pacientes, en el caso de Lenselink y Andriessen (la palabra "emparejado" se refiere al hecho de que cada paciente aporta un par de lecturas, no a que se trate de un par de grupos). Otra variante de este estudio surge cuando se toman medidas de pacientes emparejados en variables demográficas o relacionadas con la salud. El estudio de Gunes et al es un ejemplo de diseño correlacional que utiliza datos no agrupados. Estos tres diseños son probablemente las opciones más comunes de diseño de estudio en el cuidado de heridas, aunque pueden encontrarse varios otros tipos de estudio, que también pretenden inferir resultados de datos de muestra a una población, incluyendo por ejemplo pruebas de acuerdo, estudios de cribado/diagnóstico, análisis de supervivencia y metaanálisis.
Los resultados numéricos de los estudios no apareados pueden compararse mediante la prueba t de muestras independientes o, si intervienen más de dos grupos, una prueba como el análisis de la varianza (ANOVA). Los resultados categóricos suelen analizarse mediante la prueba de asociación chi-cuadrada. Para el diseño de estudio emparejado, la técnica de análisis estándar es la prueba t de muestras emparejadas o el ANOVA de medidas repetidas. Los estudios correlacionales suelen cuantificarse mediante el coeficiente de correlación de Pearson, y pueden ampliarse a un entorno de regresión lineal. Todos estos procedimientos son paramétricos y se basan en determinados supuestos de distribución de los datos; si no se cumplen estos supuestos, las técnicas no paramétricas correspondientes, como la prueba de suma de rangos, la prueba de rangos con signo, la evaluación del coeficiente de correlación de rangos de Spearman o los procedimientos de arranque pueden funcionar a menudo bastante bien. Todos los procedimientos pueden aplicarse fácilmente utilizando software estadístico estándar y todos darán lugar a una evaluación de la significación estadística medida por el valor p y dada por el software.
Mientras el valor p facilita una inferencia de significación estadística o en caso contrario, no nos da una medida de la precisión de nuestros resultados. Esta es otra cara de las evidencias inferenciales. Podemos encontrar en nuestra muestra un efecto de un tamaño determinado, pero no sería realista esperar que en la población en general exista un efecto precisamente de esa magnitud. Aunque nunca sabremos cuál es realmente el tamaño del efecto poblacional, es posible derivar un intervalo de confianza (CI), también conocido como intervalo de incertidumbre, para el mismo. A menudo se interpreta vagamente como el intervalo de valores dentro del cual podemos afirmar con un cierto grado de confianza (convencionalmente el 95%) que se encuentra un valor de la población. Más formalmente, si repitiéramos el procedimiento muchas veces, el intervalo de valores determinado cada vez contendría el verdadero parámetro poblacional en el 95% de las ocasiones.
Los CI no cuantifican la fuerza de la evidencia contra la hipótesis nula, como hace el valor p, pero sin embargo dan una medida de la precisión de una estimación (por ejemplo, la diferencia entre, o la proporción de, los valores medios en los grupos de tratamiento). En la actualidad, los CI (y la estimación del efecto en torno al cual se ajustan) se presentan cada vez más junto con los valores p en las pruebas estadísticas y a muchos les parecen más informativos y fáciles de entender. Aunque no forman parte de una prueba de hipótesis, la mayoría de los programas estadísticos informan automáticamente de un CI como subproducto de la salida de la prueba de hipótesis.
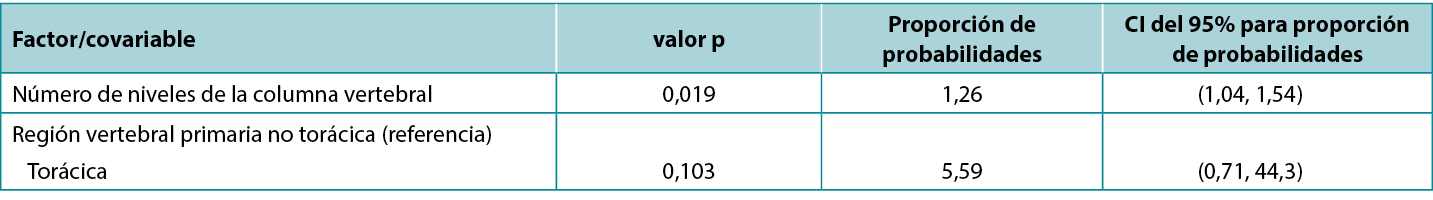
Existe una correspondencia exacta entre los CI y el valor p correspondiente: un CI del 95% que excluye el valor clave 0 (para una diferencia entre grupos de estudio) o 1 (para una proporción entre grupos de estudio) corresponde a un efecto significativo al nivel de significación del 5% (es decir, un valor p inferior a 0,05). En consecuencia, un CI del 95% que incluye un valor clave corresponde a un valor p que no es estadísticamente significativo al nivel de significación del 5% (es decir, es 0,05 o superior). Atkinson et al5 investigaron el efecto de diversos factores sobre el riesgo de infección del sitio quirúrgico durante la cirugía de la columna vertebral y, en una presentación típica de resultados tabulados (abajo), informaron de las estadísticas de un modelo que incluía tanto valores p como CI. Obsérvese que el factor niveles medulares, que es significativo según el valor p (0,019), tiene una proporción de probabilidades con un CI asociado de 1,04 a 1,54, que excluye el valor clave (para una proporción) de 1; mientras que el factor región medular, que no es significativo según el valor p (0,103), tiene una proporción de probabilidades con un CI asociado de 0,71 a 44,3, que incluye el valor clave. Esta tabla también es un buen ejemplo de cómo un efecto de magnitud relativamente pequeña (cada nivel espinal adicional se asocia a un aumento del 26% en las probabilidades de infección) puede ser significativo; mientras que un efecto de gran magnitud (la cirugía realizada en la región torácica, en lugar de la no torácica, se asocia a un aumento de aproximadamente cinco veces en las probabilidades de infección) puede no ser significativo.
Tabla 1: extracto de la tabla de datos comunicada por Atkinson et al5
La selección de una prueba estadística adecuada para un determinado diseño de estudio no siempre es sencilla y requiere una cuidadosa consideración de los parámetros del estudio. Ninguna prueba es adecuada para todos los tipos de estudios. En el caso de los estudios agrupados, como los diseños no apareados y apareados comentados anteriormente, puede que tengamos que considerar, por ejemplo, el número de grupos, el tamaño de los grupos, la distribución de los datos, la independencia de las unidades y la presencia o ausencia de factores de confusión a la hora de seleccionar una prueba. En el caso de los estudios no agrupados, como los estudios correlacionales, es posible que debamos considerar si nuestros datos se presentan en forma de datos brutos u ordenaciones de rango; y en el caso de los estudios no agrupados que evalúan múltiples factores, es posible que debamos considerar si potencialmente estamos sobreajustando nuestros datos (modelando ruido en lugar de señal) al intentar analizar demasiados factores para una muestra de un tamaño determinado.
Se necesitan medidas especiales para diseños complejos: por ejemplo, cuando los datos están agrupados (como pacientes dentro de salas de hospital, o sitios anatómicos dentro de pacientes); cuando se realizan múltiples evidencias (como puede ocurrir en estudios con múltiples medidas de resultado, cuando la variable clave del tratamiento tiene múltiples niveles, o cuando se realizan análisis separados en subgrupos de individuos y/o en múltiples puntos temporales); cuando los resultados no se conocen con exactitud (como cuando un resultado es el tiempo transcurrido hasta un acontecimiento adverso en pacientes que se controlan con poca frecuencia); cuando se realiza una serie de observaciones en los mismos pacientes; o cuando es necesario determinar una estimación sintetizada del efecto a partir de múltiples estudios. Ciertas características de los datos, como la presencia de muchos valores omitidos o no válidos, o de valores atípicos, también pueden requerir procesos estadísticos adicionales. En todas estas situaciones se recomienda solicitar el asesoramiento de un estadístico biomédico.
Author(s)
John Stephenson
PHD FRSS(GradStat) CMath(MIMA)
Senior Lecturer in Biomedical Statistics
University of Huddersfield, United Kingdom
Email J.Stephenson@hud.ac.uk
References
- Stephenson, J. (2022). Descriptive presentation of wound care data. World Council of Enterostomal Therapists Journal. 42, 3, p. 30-33
- Miller C, McGuiness W, Wilson S, Cooper K, Swanson T, Rooney D, Piller N, Woodward M (2017). Concordance and acceptability of electric stimulation therapy: a randomised controlled trial. Journal of Wound Care Vol. 26, No. 8. https://doi-org.libaccess.hud.ac.uk/10.12968/jowc.2017.26.8.508
- Lenselink E, Andriessen A (2011). A cohort study on the efficacy of a polyhexanide-containing biocellulose dressing in the treatment of biofilms in wounds. Journal of Wound Care 20 (534)
- Gunes EA, Eren MA, Koyuncu I, Taskin A, Sabuncu T (2018). Investigation of galectin-3 levels in diabetic foot ulcers. Journal of Wound Care (27); 12
- Atkinson R, Stephenson J, Jones A, Ousey K. An assessment of key risk factors for surgical site infection in patients undergoing surgery for spinal metastases J Wound Care 2016; 25(S9); S30-S34



