Volume 43 Number 2
Delving into skin and soft tissue infections (SSTI). Part III: focus on cellulitis
Caley Shukalek, Vidhi Desai, Brandon Christensen, Christopher Lata, Ranjani Somayaji
Keywords soft tissue infection, case-based review, cellulitis
For referencing Shukalek C et al. Delving into skin and soft tissue infections (SSTI). Part III: focus on cellulitis. WCET® Journal 2023;43(2):24-28
DOI
https://doi.org/10.33235/wcet.43.2.24-28
Submitted 27 July 2022
Accepted 6 June 2023
Abstract
In this third part of a series of articles (Part I WCET® Journal Volume 36 Number 2 – April/June 2016: PP29-34; Part II WCET® Journal Volume 37 Number 3 – July/September 2017: PP20-24) on skin and soft tissue infections (SSTI), cellulitis syndromes are explored. A case-based approach to the diagnosis and management of cellulitis for clinicians is discussed.
Introduction
Skin and soft tissue infections (SSTI) represent a spectrum of diseases, from mild superficial infection such as erysipelas and cellulitis to deep fascial infections as seen in necrotising fasciitis. The presentations vary but are common both within primary and acute care settings. The burden of SSTI is vast, with rates rising through the late 1990s–2000s, attributed to increasing age and comorbidities such as obesity1. However, there are no significant differences between men and women2. A US-based study in 2010 showed SSTI to be two-times more common than UTI and 10 times more common than pneumonia, with rates as high as 48.5 cases per 1000 person years3. Similarly, a study examining rates of cellulitis in the US between 1998–2013 demonstrated the rates of acute hospitalisation were nearly double, with costs totalling nearly US$3.74 billion4. At the same time, a challenging aspect of cellulitis and other SSTI is diagnosis, with a reliance on clinical history and physical examination. The absence of objective microbiological or laboratory testing allows for non-infectious aetiologies to be mistakenly diagnosed as SSTI. This too is costly to the system, with one study showing up to 30% of patients admitted with lower limb cellulitis were misdiagnosed, with an estimated cost of between US$195–515 million5.
Endeavours to develop aids in the diagnosis of cellulitis have been undertaken; however, challenges remain around developing ‘gold standard’ diagnostics and appropriate comparators, given the heterogeneity of alternative diagnoses. A 2019 systematic review found several tools to aid in diagnosis; however, none were adequately validated for lower limb cellulitis6.
As previously discussed, SSTI often result from minor superficial trauma to the skin barrier7,8. Trauma can come in the form of external damage to the skin, chronic venous insufficiency, or inflammation4,9,10.
Cellulitis Overview
Clinical manifestations
Cellulitis is a rapidly progressive SSTI involving the dermis and subcutaneous tissues11. Symptoms typically include acute onset redness, warmth, oedema and pain, but can occasionally include systemic symptoms such as fevers and rigours. Most commonly, cellulitis is found on the lower extremities, with rates as high as 39.9% of all cellulitis12. As mentioned previously, damage to the skin surface through trauma, inflammation or oedema typically precedes infection. Less commonly, cellulitis can occur due to spread of an infection from the bloodstream or a contiguous source (i.e. abscess in the fat tissue expanding outward)2.
Numerous risk factors exist for the primary/first episode of cellulitis, including homelessness, advanced age, obesity, skin breakdown (ulcers, inflammation, trauma), oedema/lymphoedema, toe web infections (fungal, bacterial) venous insufficiency and previous venectomy among others13. At the same time, risk factors for recurrent cellulitis include obesity, tinea pedis, oedema/lymphoedema and venous insufficiency, but also smoking, malignancy and previous cellulitis1. Recurrence rates of cellulitis following a primary episode are high but ranges vary depending on the study, with some reporting ~8–20%12 while others show between 22–49% when risk factors are present1.
Non-necrotising and non-purulent infections rarely cause mortality1. However, the estimated overall mortality rate for cellulitis is reported to be 1.1%, although infection itself may only be the culprit in up to one third of cases1,14. The vast majority of infections are caused by Staphylococcus aureus and streptococci and, in one study, where microbiologic diagnoses were confirmed, these two pathogenic groups were cultured 97% of the time13.
Several scoring systems have been developed, including the ERON15 and the modified Dundee classification, which have been included in the UK CREST guidelines16. However, these criteria have not been widely adopted and have been criticised for being overly simplified or not clinically robust in distinguishing severity11,17.
Interestingly, recent studies have shown the incidence of cellulitis can vary by season. One such study out of Denver showed a trend toward higher rates of admissions for primary cellulitis in warmer months, with July having 66.63% higher odds of infection compared to the colder winter months18. At the same time, a study out of southwestern Taiwan showed rates of lower extremity cellulitis increased in the days immediately following a typhoon, suggesting climates prone to floods and excessive precipitation may place occupants at risk of cellulitis with enteric, gram-negative and water-borne organisms due to exposure to contaminated water19. One explanation may be soaking of the extremities for prolonged periods, thus impairing natural host defence systems and facilitating a portal of entry through the skin surface19. Furthermore, during climate disasters, bites from animals and insects may also contribute to increased rates of infection18.
Pathogenesis
Once superficial damage occurs to the skin surface, bacterial contamination with the patient’s own skin flora can occur. This explains why staphylococcal and streptococcal species are the most prevalent organisms in cellulitis. Successful infection occurs in three steps – the bacteria must first adhere to the host’s cells, then invade the tissue while evading the host’s defences, and finally utilise its toxigenic factors19. A cytokine and neutrophil response are triggered after bacteria penetrate the skin. This epidermal response results in antimicrobial peptide production and keratinocyte proliferation, both of which induce the characteristic examination findings of cellulitis2. The portal of entry is not always evident, particularly as cellulitis can occur with seemingly intact skin in the context of other risk factors. In these instances, microscopic cracks occur in skin; these become irritated or inflamed, thus facilitating bacterial migration inward20.
Clinical approach / microbiology
Cellulitis can be classified into non-purulent and purulent forms based on the clinical presentation. Non-purulent cellulitis, classically caused by streptococci, presents as a unilateral, poorly demarcated, warm and red area lacking purulent discharge or abscess. Conversely, purulent cellulitis, classically caused by staphylococci, generally develops around wounds, collections or carbuncles. In both, there is surrounding oedema and tenderness to palpation which can expand rapidly as the infection progresses. Other local features can include local necrosis and abscess formation (subsequent to cellulitis process) based on the bacterial species and infection severity.
S. aureus is more frequently associated with purulent cellulitis, although both bacterial species are capable of severe infectious features based on the virulence factors of the infecting strain. Other streptococci that are also implicated in cellulitis include Group B, C and G streptococcus – these are more common in persons with diabetes or vascular disease. As a wound becomes chronic, there is a transition of skin flora to one that is polymicrobial with colonisation by enteric gram-negatives, anaerobes or environmental pathogens. Following a similar pathogenesis, these organisms can cause infection, often in those with untreated wounds, poor circulation, or diabetic foot ulcers21.
More atypical organisms can be involved in cellulitis, including those seen in animal bite, fresh/salt water, or aquarium exposures. These are often identified with careful history and require broader spectrum therapies which are beyond the scope of this review.
Differential diagnosis
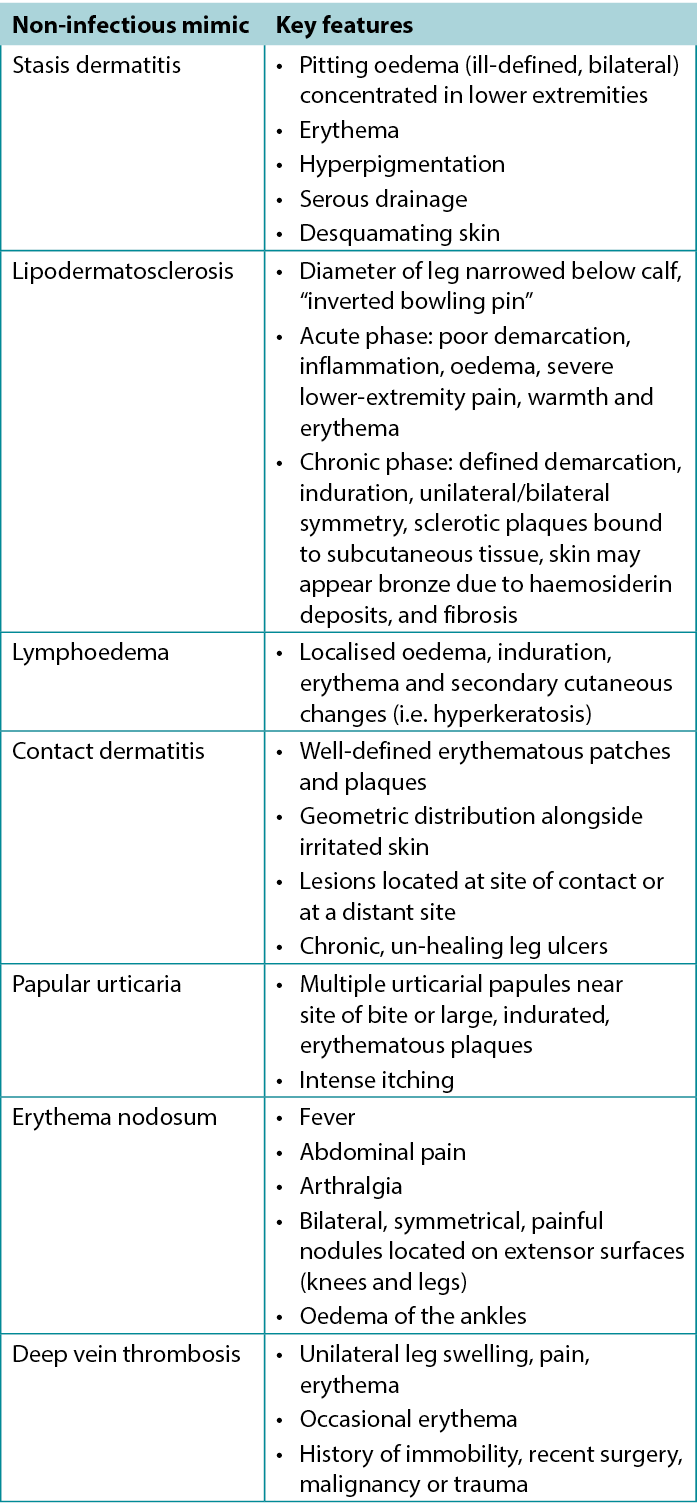
Given the wide spectrum of dermatologic conditions, the largely subjective nature of history and physical examination, and the non-specific symptoms (i.e. tenderness, erythema, oedema) seen in the skin, cellulitis is frequently misdiagnosed22. Syndromes that mimic cellulitis include statis dermatitis, lipodermatosclerosis and lymphoedema; these are summarised in Table 122. Stasis dermatitis is the most common mimic of cellulitis, although it tends to be slower onset and more often bilateral. However, stasis dermatitis and other mimics are risk factors for SSTI and, as such, infection should remain on the differential. Lymphoedema refers to oedema resulting from abnormal lymphatic flow of any cause and presents most commonly as a unilateral non-pitting oedema. There can be associated erythema due to inflammation, but pain and warmth may not be present. Other conditions that can mimic infections include contact dermatitis and papular urticaria, both relating to a dermal sensitivity reaction to an allergen or insect bite22. Generally, addressing other factors such as systemic signs, laboratory tests and occasionally biopsy can assist in making a diagnosis in more challenging cases23.
Table 1. Characteristics of non-infectious mimics of cellulitis
The differentiation between erysipelas and cellulitis is often challenging, but often not clinically relevant. Erysipelas, by definition, involves the superficial epidermis, whereas cellulitis involves the dermis and subcutaneous tissues24. Cellulitis and erysipelas both have similar clinical presentations; however, cellulitis usually presents as a flat, erythematous patch. Erysipelas, however, may be raised and tends to be more well demarcated than cellulitis, with clear margins between infected and uninfected skin25. Additionally, erysipelas is more classically described in the face25. In light skinned individuals, lesions also differ in colour, with cellulitis being more pink and erysipelas being described classically as ‘salmon-red’. Clinically, both erysipelas and cellulitis are treated with similar agents and for similar duration24.
A final important differential consideration are necrotising SSTI, including necrotising fasciitis. While erythematous skin changes are common to both, necrotising fasciitis tends to be exquisitely painful, beyond what the clinician would expect of the skin changes present. In contrast to cellulitis, there are often systemic symptoms, including fever, hypotension, tachycardia or altered level of consciousness, but these findings may be late in the disease process26. Additionally, there may be blisters, bullae, skin discolouration, crepitus (presence of gas under the skin), pain, and rapid extension of erythema within hours26.
Therapy
The degree of clinical severity determines the type of treatment that is needed for cellulitis; a guideline detailing treatment approaches can be found elsewhere24. Cases of cellulitis that lack systemic signs of infection (i.e. fever, tachycardia) can be treated with an oral antimicrobial agent that is active against streptococci alone (mild cases). Moderate–severe cases may require intravenous antimicrobials initially, with a subsequent step down to oral antibiotics after a period of improvement. For severe infections, empiric coverage against methicillin-resistant S. aureus (MRSA) may be considered based on the location of infection, risk factors, and local MRSA prevalence. In purulent cellulitis, incision and drainage may be indicated alongside antimicrobial therapies.
Although classical descriptions exist to differentiate streptococcal and staphylococcal cellulitis, the distinctions are not generally clear and, as such, agents with activity against both are often used. For treatment, penicillins with staphylococcal activity or cephalosporins are frequently used, with the latter also used in cases of penicillin allergy – for severe reactions other classes will be considered. Clinical improvements often lag antimicrobial therapy by 24–48 hours and at times erythema can extend27. In these cases, it is often appropriate to continue with therapy and reassess at 72 hours, when the body’s inflammatory response begins to subside. In the absence of improvement at 72 hours, the diagnosis or choice of therapy may need to be reassessed.
Prevention
As described above, recurrence is a common and costly in cellulitis, with each additional episode causing more inflammatory damage to the lymphatic system, thus perpetuating the problem28. Non-pharmacological prevention options include regular moisturisation, prevention of toe-space infections (tinea pedis), weight loss, regular exercise, and lower leg compression therapy (e.g. compression stockings29). While there is no evidence for topical solutions to prevent cellulitis, topical antibiotic ointments have been shown to reduce infection in acute lacerations and wounds28,30. After initiating the non-pharmacological options above, if recurrent cellulitis remains an issue, low dose suppressive penicillin has been shown to be effective in preventing recurrent cellulitis27.
Case studies
Case 1
Ms Lee is a 35-year-old otherwise healthy woman who presents with a 2-day history of fever, redness, pain and swelling around her left ear. There was no recent trauma or injury. There is no previous history of dermatologic ailments in the head or neck, including eczema. Physical examination reveals a fever of 38.5˚C, heart rate of 90 beats per minute, and blood pressure of 95/60 (normal). Examination of the left ear itself reveals a normal tympanic membrane with no drainage or lesions. There is marked erythema and induration around the left ear with tender pre-auricular nodes. Note is made of an ‘ear pit’ or preauricular sinus proximal to the tragus of the left ear (Figure 1).
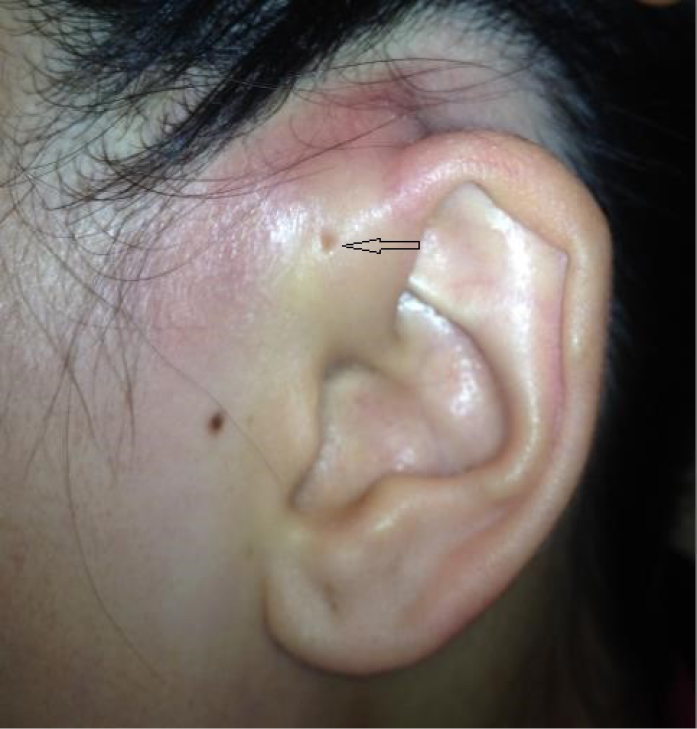
Figure 1. Case study 1.
On further questioning, Ms Lee reveals that her mother had a similar sinus which became infected in her 30s and required surgical removal. Ms Lee is initiated on cefazolin 2g IV every 8 hours for 72 hours via home parenteral pump after which she has a 40% improvement. She is stepped down to cephalexin 500mg PO four times daily for 4 days to complete a total 7-day course. She is also referred to the otolaryngology service for consideration of surgical removal of the sinus once her symptoms are resolved.
In case 1, we see an atypical presentation of cellulitis of the outer ear, with the likely risk factor being the anatomical variant described. Therapy targeting staphylococci and streptococci yield clinical improvement. To prevent recurrence, surgical consultation and intervention may be required.
Case 2
Mr Brown is a 56-year-old businessman with no past medical history and no obesity. He presents to the emergency department with a 48-hour history of swollen, erythematous and painful left lower leg after a month-long trip to Turkey. He has just returned home after an >8-hour flight. Pain began prior to the flight but has worsened in recent days. In the emergency department he is mildly tachycardic (HR105), normotensive and afebrile. Other haemodynamic markers are within normal limits. His blood work demonstrates a white blood cell count of 16,000 with elevated CRP. Other laboratorial parameters are within normal limits. A doppler ultrasound of the left leg rules out deep vein thrombosis.
There is no preceding trauma or injury, and no apparent risk factors for cellulitis. The ED physician makes a diagnosis of cellulitis based on the patients presenting clinical history of a swollen, painful erythematous lower leg and exclusion of DVT. He is started on cefazolin 2g IV every 8 hours and discharged home via home parenteral pump. He is followed up in clinic and after 5 days of parenteral therapy has not improved. Treatment is broadened with anti-MRSA therapy in the form of Doxycycline and 3 days later improvement is minimal. Additional history obtained elucidates frequent swimming in pools and fresh/saltwater lakes while abroad. The decision is made to discontinue parenteral therapy at the patient’s request. He is started on highly bioavailable oral ciprofloxacin for empiric gram-negative coverage in addition to the gram-positive/MRSA coverage provided by doxycycline. Five days later, the redness, erythema and swelling have reduced 80%. He completes a 7-day course of this combined therapy.
Case 2, on the other hand, introduces two unique considerations. The first is the need to rule out possible differentials, in this case deep vein thrombosis, given the history of long-haul flight. The second consideration are organisms beyond staphylococci and streptococci. As discussed, improvement with typical therapies should be seen within 72 hours. When this has not occurred, re-examining the history and differential is often important. Here, a history of multiple water exposures has been uncovered, leading the clinician to consider therapies targeting gram-negative and environmental pathogens. The ultimate improvement once on anti-gram-negative therapy confirms the diagnosis.
Conclusion
Cellulitis and SSTI are an increasing burden to the healthcare system world-wide, owing to the rise in age and comorbidities. Diagnosis and management present major challenges given the absence of gold standard, inter-clinician variability, and the large number of mimics. However, emerging evidence around prevention provides an unique opportunity to prevent morbidity and avoid additional healthcare costs.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Profundizar en las infecciones de la piel y los tejidos blandos (SSTI). Parte III: centrada en la celulitis
Caley Shukalek, Vidhi Desai, Brandon Christensen, Christopher Lata, Ranjani Somayaji
DOI: https://doi.org/10.33235/wcet.43.2.24-28
Resumen
En esta tercera parte de una serie de artículos (Parte I Revista WCET® Volumen 36 Número–2 - Abril/Junio 2016: PP29-34; Parte II Revista WCET® Volumen 37 Número–3 - Julio/septiembre de 2017: PP20-24) sobre infecciones de la piel y tejidos blandos (SSTI), se exploran los síndromes de celulitis. Se expone un enfoque basado en casos para el diagnóstico y tratamiento de la celulitis destinado a los clínicos.
Introducción
Las infecciones de la piel y los tejidos blandos (SSTI) representan un espectro de enfermedades, desde la infección superficial leve, como la erisipela y la celulitis, hasta las infecciones fasciales profundas, como las que se observan en la fascitis necrotizante. Las presentaciones varían, pero son comunes tanto en los centros de atención primaria como en los de agudos. La carga de SSTI es enorme, y las tasas aumentaron a finales de 1990-2000, atribuidas al aumento de la edad y a comorbilidades como la obesidad1. Sin embargo, no existen diferencias significativas entre hombres y mujeres2. Un estudio realizado en EE. UU. en 2010 demostró que las SSTI son dos veces más frecuentes que las infecciones urinarias y 10 veces más frecuentes que la neumonía, con tasas de hasta 48,5 casos por 1000 personas-año3. Del mismo modo, un estudio que examinó las tasas de celulitis en EE. UU. entre 1998 y 2013 demostró que las tasas de hospitalización aguda eran casi el doble, con unos costes totales de casi 3.740 millones dedólares4. Al mismo tiempo, un aspecto difícil de la celulitis y otras SSTI es el diagnóstico, que se basa en la historia clínica y la exploración física. La ausencia de pruebas microbiológicas o de laboratorio objetivas permite que etiologías no infecciosas se diagnostiquen erróneamente como SSTI. Esto también es costoso para el sistema, ya que un estudio demostró que hasta el 30% de los pacientes ingresados con celulitis de las extremidades inferiores fueron diagnosticados erróneamente, con un coste estimado de entre 195 y 515 millones de dólares5.
Se han emprendido esfuerzos para desarrollar ayudas al diagnóstico de la celulitis; sin embargo, sigue habiendo retos en torno al desarrollo de diagnósticos de referencia y comparadores apropiados, dada la heterogeneidad de los diagnósticos alternativos.Una revisión sistemática de 2019 encontró varias herramientas de ayuda al diagnóstico; sin embargo, ninguna estaba adecuadamente validada para la celulitis de las extremidades inferiores6.
Como ya se ha comentado anteriormente, las SSTI suelen ser el resultado de pequeños traumatismos superficiales en la barrera cutánea7,8. Los traumatismos pueden presentarse en forma de lesiones externas de la piel, insuficiencia venosa crónica o inflamación4,9,10.
Celulitis vision general
Manifestaciones clínicas
La celulitis es una rápida y progresiva SSTI que afecta a la dermis y a los tejidos subcutáneos11. Los síntomas suelen incluir enrojecimiento, calor, edema y dolor de aparición aguda, pero ocasionalmente pueden incluir síntomas sistémicos como fiebre y rigidez. Lo más frecuente es que la celulitis afecte a las extremidades inferiores, con tasas de hasta el 39,9% de todas las celulitis12. Como se ha mencionado anteriormente, el daño en la superficie de la piel por traumatismo, inflamación o edema suele preceder a la infección. Con menor frecuencia, la celulitis puede producirse debido a la propagación de una infección procedente del torrente sanguíneo o de una fuente contigua (p. ej, un absceso en el tejido adiposo que se expande hacia el exterior)2.
Existen numerosos factores de riesgo para el primer episodio de celulitis, como la falta de hogar, la edad avanzada, la obesidad, las alteraciones cutáneas (úlceras, inflamación, traumatismos), el edema/linfedema, las infecciones de las membranas de los dedos de los pies (fúngicas, bacterianas), la insuficiencia venosa y la venectomía previa, entreotros13. Al mismo tiempo, los factores de riesgo de celulitis recurrente incluyen la obesidad, la tiña pedis, el edema/linfedema y la insuficiencia venosa, pero también el tabaquismo, las neoplasias malignas y la celulitis previa1. Las tasas de recurrencia de la celulitis tras un episodio primario son elevadas, pero los rangos varían en función del estudio: con algunos informes de un~8-20%12 , mientras que otros muestran entre un 22-49% cuando existen factores de riesgo1.
Las infecciones no necrotizantes y no purulentas rara vez causan mortalidad1. Sin embargo, la tasa de mortalidad global estimada de la celulitis es del 1,1%, aunque la infección en sí sólo puede ser la culpable en hasta un tercio de los casos1,14. La gran mayoría de las infecciones están causadas por Staphylococcus aureus y estreptococos y, en un estudio, en el que se confirmaron los diagnósticos microbiológicos, estos dos grupos patógenos se cultivaron en el 97% de las veces13.
Se han desarrollado varios sistemas de puntuación, como el ERON15 y la clasificación de Dundee modificada, que se han incluido en las directrices CREST del Reino Unido16. Sin embargo, estos criterios no se han adoptado de forma generalizada y han sido criticados por estar excesivamente simplificados o por no ser clínicamente sólidos a la hora de distinguir la gravedad11,17.
Curiosamente, estudios recientes han demostrado que la incidencia de la celulitis puede variar según la estación. Uno de estos estudios, realizado en Denver, mostró una tendencia hacia tasas más elevadas de ingresos por celulitis primaria en los meses más cálidos, con un 66,63% más de probabilidades de infección en julio que en los meses más fríos del invierno18. Al mismo tiempo, un estudio realizado en el suroeste de Taiwán mostró que las tasas de celulitis de las extremidades inferiores aumentaban en los días inmediatamente posteriores a un tifón, lo que sugiere que los climas propensos a inundaciones y precipitaciones excesivas pueden exponer a los ocupantes al riesgo de celulitis por organismos entéricos, gramnegativos y transmitidos por el agua debido a la exposición a agua contaminada19. Una explicación puede ser el remojo de las extremidades durante periodos prolongados, lo que altera los sistemas de defensa naturales del huésped y facilita un portal de entrada a través de la superficie cutánea19. Además, durante las catástrofes climáticas, las picaduras de animales e insectos también pueden contribuir a aumentar las tasas de infección18.
Patogénesis
Una vez que se produce un daño superficial en la superficie de la piel, puede producirse una contaminación bacteriana con la flora cutánea del propio paciente. Esto explica por qué las especies estafilocócicas y estreptocócicas son los organismos más prevalentes en la celulitis. El éxito de la infección se produce en tres pasos: primero, la bacteria debe adherirse a las células del huésped, después invadir el tejido eludiendo las defensas del huésped y, por último, utilizar sus factores toxigénicos19. Una vez que las bacterias penetran en la piel, se desencadena una respuesta de citocinas y neutrófilos. Esta respuesta epidérmica da lugar a la producción de péptidos antimicrobianos y a la proliferación de queratinocitos, que inducen los hallazgos característicos de la celulitis2. El portal de entrada no siempre es evidente, sobre todo porque la celulitis puede aparecer con la piel aparentemente intacta en el contexto de otros factores de riesgo. En estos casos, se producen grietas microscópicas en la piel; éstas se irritan o inflaman, facilitando así la migración bacteriana hacia el interior20.
Enfoque clínico / microbiología
La celulitis puede clasificarse en formas no purulentas y purulentas en función de la presentación clínica. La celulitis no purulenta, causada clásicamente por estreptococos, se presenta como una zona unilateral, mal delimitada, caliente y enrojecida que carece de secreción purulenta o absceso. Por el contrario, la celulitis purulenta, causada clásicamente por estafilococos, se desarrolla generalmente alrededor de heridas, colecciones o carbuncos. En ambos casos, hay edema circundante y sensibilidad a la palpación que puede expandirse rápidamente a medida que progresa la infección. Otras características locales pueden incluir necrosis local y formación de abscesos (posteriores al proceso de celulitis) en función de la especie bacteriana y la gravedad de la infección.
S. aureus se asocia con mayor frecuencia a la celulitis purulenta, aunque ambas especies bacterianas son capaces de presentar características infecciosas graves en función de los factores de virulencia de la cepa infectante. Otros estreptococos que también están implicados en la celulitis son los estreptococos de los grupos B, C y G, que son más frecuentes en personas con diabetes o enfermedades vasculares. Cuando una herida se cronifica, se produce una transición de la flora cutánea a una flora polimicrobiana con colonización por gramnegativos entéricos, anaerobios o patógenos ambientales. Siguiendo una patogenia similar, estos organismos pueden causar infecciones, a menudo en personas con heridas no tratadas, mala circulación o úlceras de pie diabético21.
En la celulitis pueden estar implicados organismos más atípicos, incluidos los que se observan en mordeduras de animales, agua dulce/salada o exposiciones en acuarios. A menudo se identifican con una cuidadosa anamnesis y requieren terapias de espectro más amplio que quedan fuera del alcance de esta revisión.
Diagnóstico diferencial
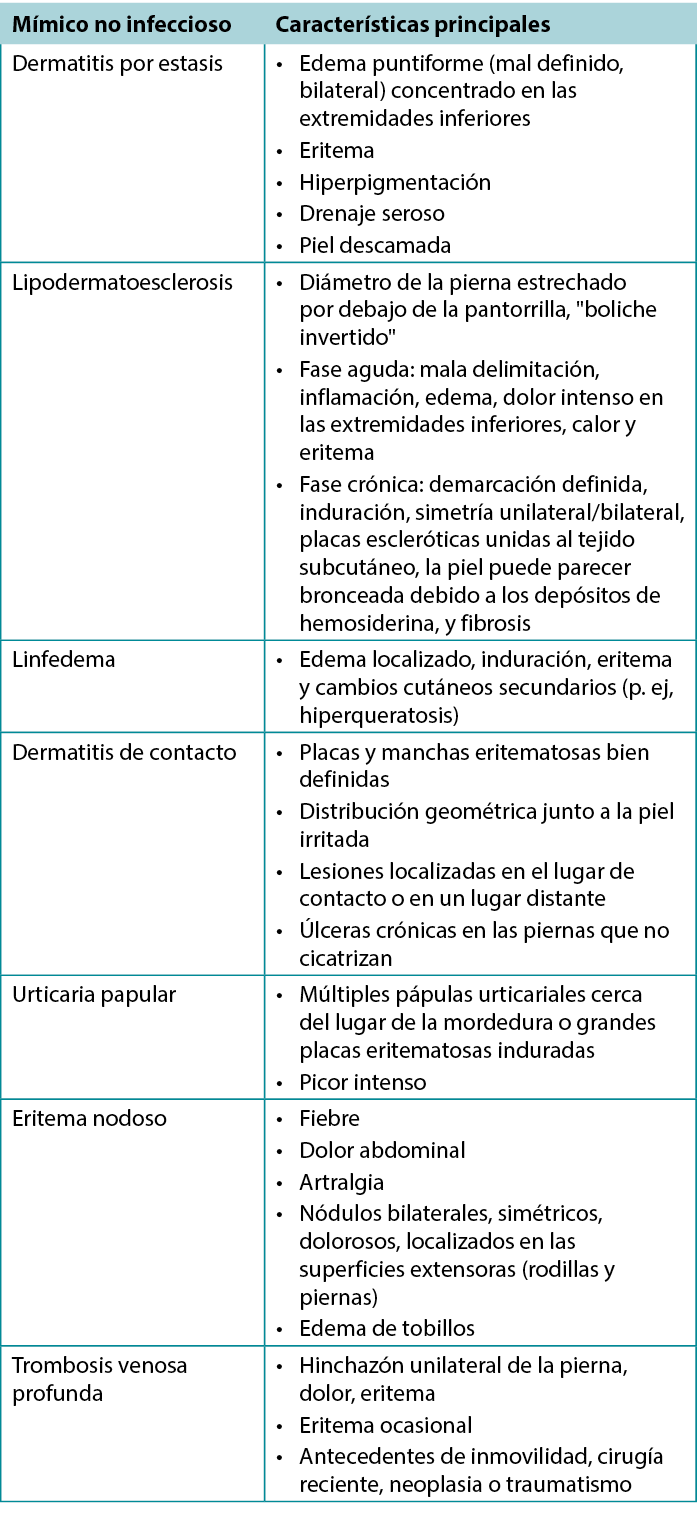
Dado el amplio espectro de afecciones dermatológicas, la naturaleza en gran medida subjetiva de la anamnesis y la exploración física, y los síntomas inespecíficos (p. ej sensibilidad, eritema, edema) que se observan en la piel, la celulitis suele diagnosticarse erróneamente22. Entre los síndromes que imitan la celulitis se encuentran la dermatitis estadística, la lipodermatoesclerosis y el linfedema; éstos se resumen en el cuadro 122. La dermatitis por estasis es el síntoma más frecuente de celulitis, aunque suele ser de aparición más lenta y bilateral. Sin embargo, la dermatitis por estasis y otras imitaciones son factores de riesgo de SSTI y, como tales, la infección debe permanecer en el diferencial. El linfedema se refiere al edema resultante de un flujo linfático anormal de cualquier causa y se presenta con mayor frecuencia como un edema unilateral no puntiforme. Puede haber eritema asociado debido a la inflamación, pero el dolor y el calor pueden no estar presentes. Otras afecciones que pueden simular infecciones son la dermatitis de contacto y la urticaria papular, ambas relacionadas con una reacción de sensibilidad dérmica a un alérgeno o a la picadura de un insecto22. Por lo general, el tratamiento de otros factores como los signos sistémicos, las pruebas de laboratorio y, ocasionalmente, la biopsia pueden ayudar a establecer un diagnóstico en los casos más difíciles23.
Tabla 1. Características de las imitaciones no infecciosas de la celulitis
La diferenciación entre erisipela y celulitis suele ser difícil, pero a menudo no es clínicamente relevante. La erisipela, por definición, afecta a la epidermis superficial, mientras que la celulitis afecta a la dermis y los tejidos subcutáneos24. Tanto la celulitis como la erisipela tienen presentaciones clínicas similares; sin embargo, la celulitis suele presentarse como un parche eritematoso plano. La erisipela, sin embargo, puede ser elevada y tiende a estar mejor delimitada que la celulitis, con márgenes claros entre la piel infectada y la no infectada25. Además, la erisipela se describe más clásicamente en la cara25. En los individuos de piel clara, las lesiones también difieren en color, siendo la celulitis más rosada y la erisipela descrita clásicamente como "rojo salmón". Clínicamente, tanto la erisipela como la celulitis se tratan con agentes similares y durante un tiempo similar24.
Una última consideración diferencial importante son las SSTI necrotizantes, incluida la fascitis necrotizante. Aunque los cambios eritematosos de la piel son comunes a ambas, la fascitis necrotizante tiende a ser exquisitamente dolorosa, más allá de lo que el clínico esperaría de los cambios cutáneos presentes. A diferencia de la celulitis, suele haber síntomas sistémicos, como fiebre, hipotensión, taquicardia o alteración del nivel de conciencia, pero estos hallazgos pueden producirse en una fase tardía del proceso de la enfermedad26. Además, puede haber ampollas, bullas, decoloración de la piel, crepitación (presencia de gas bajo la piel), dolor y rápida extensión del eritema en cuestión de horas26.
Terapia
El grado de gravedad clínica determina el tipo de tratamiento que se necesita para la celulitis; en otro lugar se puede encontrar una guía en la que se detallan los enfoques terapéuticos24. Los casos de celulitis que carecen de signos sistémicos de infección (p. ej fiebre, taquicardia) pueden tratarse con un agente antimicrobiano oral que sea activo únicamente contra los estreptococos (casos leves). Los casos moderados-graves pueden requerir inicialmente antimicrobianos intravenosos, con una posterior reducción a antibióticos orales tras un periodo de mejoría. Para las infecciones graves, puede considerarse la cobertura empírica contra el S. aureus resistente a la meticilina (MRSA) en función de la localización de la infección, los factores de riesgo y la prevalencia local del MRSA. En la celulitis purulenta, la incisión y el drenaje pueden estar indicados junto con terapias antimicrobianas.
Aunque existen descripciones clásicas para diferenciar la celulitis estreptocócica de la estafilocócica, las distinciones no suelen ser claras y, por ello, a menudo se utilizan agentes con actividad contra ambas. Para el tratamiento, se utilizan frecuentemente penicilinas con actividad estafilocócica o cefalosporinas, estas últimas también utilizadas en caso de alergia a la penicilina - para las reacciones graves se considerarán otras clases. Las mejoras clínicas suelen retrasarse 24-48 horas con respecto a la terapia antimicrobiana y, en ocasiones, el eritema puede prolongarse27. En estos casos, suele ser adecuado continuar con la terapia y volver a evaluar a las 72 horas, cuando la respuesta inflamatoria del organismo empieza a remitir. En ausencia de mejoría a las 72 horas, puede ser necesario reevaluar el diagnóstico o la elección del tratamiento.
Prevención
Como se ha descrito anteriormente, la recurrencia es frecuente y costosa en la celulitis, ya que cada episodio adicional causa más daño inflamatorio al sistema linfático, perpetuando así el problema28. Las opciones de prevención no farmacológicas incluyen la hidratación regular, la prevención de las infecciones de los dedos de los pies (tinea pedis), la pérdida de peso, el ejercicio regular y la terapia de compresión de la parte inferior de la pierna (p. ej, medias de compresión29). Aunque no hay pruebas de que las soluciones tópicas prevengan la celulitis, se ha demostrado que las pomadas antibióticas tópicas reducen la infección en laceraciones y heridas agudas28,30. Tras iniciar las opciones no farmacológicas anteriores, si la celulitis recurrente sigue siendo un problema, se ha demostrado que la penicilina supresora a dosis bajas es eficaz para prevenir la celulitis recurrente27.
Estudio de caso
Caso 1
La Sra. Lee es una mujer de 35 años, por lo demás sana, que presenta una historia de 2 días de fiebre, enrojecimiento, dolor e hinchazón alrededor de la oreja izquierda. No había traumatismos ni lesiones recientes. No hay antecedentes de dolencias dermatológicas en la cabeza o el cuello, incluido el eczema. La exploración física revela una fiebre de 38,5˚C, una frecuencia cardiaca de 90 latidos por minuto y una tensión arterial de 95/60 (normal). El examen del oído izquierdo revela una membrana timpánica normal, sin drenaje ni lesiones. Hay eritema marcado e induración alrededor de la oreja izquierda con ganglios preauriculares sensibles. Se observa una "fosa auricular" o seno preauricular proximal al tragus de la oreja izquierda (Figura 1).
En un interrogatorio posterior, la Sra. Lee revela que su madre tuvo un seno similar que se infectó a los 30 años y requirió extirpación quirúrgica. A la Sra. Lee se le suministra cefazolina 2g IV cada 8 horas durante 72 horas mediante bomba parenteral domiciliaria, tras lo cual presenta una mejoría del 40%. Se reduce a cefalexina 500 mg PO cuatro veces al día durante 4 días para completar un tratamiento total de 7 días. También es remitida al servicio de otorrinolaringología para que se considere la extirpación quirúrgica del seno una vez resueltos los síntomas.
En el caso 1, vemos una presentación atípica de la celulitis del oído externo, siendo el factor de riesgo probable la variante anatómica descrita. La terapia dirigida de estafilococos y estreptococos produce una mejoría clínica. Para prevenir la recurrencia, puede ser necesaria la consulta e intervención quirúrgica.

Figura 1. Estudio de caso 1.
Caso 2
El Sr. Brown es un hombre de negocios de 56 años sin antecedentes médicos ni obesidad. Acude al servicio de urgencias con una historia de 48 horas de inflamación, eritema y dolor en la parte inferior de la pierna izquierda tras un viaje de un mes a Turquía. Acaba de regresar a casa tras un vuelo de más de 8 horas. El dolor comenzó antes del vuelo, pero ha empeorado en los últimos días. En el servicio de urgencias se encuentra ligeramente taquicárdico (HR105), normotenso y afebril. Los demás marcadores hemodinámicos están dentro de los límites normales. Su análisis de sangre muestra un recuento de glóbulos blancos de 16.000 con CRP elevada. Los demás parámetros de laboratorio están dentro de los límites normales. Una ecografía doppler de la pierna izquierda descarta una trombosis venosa profunda.
No hay traumatismos ni lesiones precedentes, ni factores de riesgo aparentes de celulitis. El médico de urgencias hace un diagnóstico de celulitis basándose en la historia clínica del paciente, que presenta una pierna hinchada, eritematosa y dolorosa, y excluye la TVP. Se le empieza a administrar cefazolina 2g IV cada 8 horas y se le da el alta a casa mediante bomba parenteral domiciliaria. Se le realiza un seguimiento clínico y tras 5 días de terapia parenteral no ha mejorado. Se amplía el tratamiento con terapia anti-MRSA en forma de Doxiciclina y 3 días después la mejoría es mínima. Los antecedentes adicionales obtenidos aclaran que nadaba con frecuencia en piscinas y lagos de agua dulce/salada mientras estaba en el extranjero. Se toma la decisión de interrumpir la terapia parenteral a petición del paciente. Se inicia con ciprofloxacino oral de alta biodisponibilidad para la cobertura empírica de gran-negativos, además de la cobertura de gran-positivos/MRSA proporcionada por la doxiciclina. Cinco días después, el enrojecimiento, el eritema y la inflamación se han reducido en un 80%. Completa un ciclo de 7 días de esta terapia combinada.
El caso 2, en cambio, introduce dos consideraciones únicas. La primera es la necesidad de descartar posibles diferenciales, en este caso la trombosis venosa profunda, dado el antecedente de vuelo de larga distancia. La segunda consideración son los organismos más allá de los estafilococos y los estreptococos. Como ya se ha comentado, la mejoría con las terapias típicas debería observarse en 72 horas. Cuando esto no ha ocurrido, a menudo es importante reexaminar los antecedentes y el diagnóstico diferencial. En este caso, se ha descubierto una historia de múltiples exposiciones al agua, lo que lleva al clínico a considerar terapias dirigidas a patógenos gran-negativos y ambientales. La mejoría definitiva una vez en terapia anti-gram-negativa confirma el diagnóstico.
Conclusión
La celulitis y las SSTI suponen una carga cada vez mayor para el sistema sanitario mundial, debido al aumento de la edad y de las comorbilidades. El diagnóstico y el tratamiento plantean grandes retos dada la ausencia de una prueba de referencia, la variabilidad entre médicos y el gran número de imitadores. Sin embargo, los nuevos datos sobre prevención ofrecen una oportunidad única para prevenir la morbilidad y evitar costes sanitarios adicionales.
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Financiación
Los autores no recibieron financiación por este estudio.
Author(s)
Caley Shukalek†
MD, MSc
Department of Medicine, University of Calgary, Calgary, AB, Canada
Vidhi Desai†
BSc student
University of Calgary, Calgary, AB, Canada
Brandon Christensen
MD
Department of Medicine, University of Calgary, Calgary, AB, Canada
Christopher Lata
MD, MSc
Department of Medicine, University of Calgary, Calgary, AB, Canada
Ranjani Somayaji*
MD, MPH
Assistant Professor, Departments of Medicine and Microbiology, Immunology & Infectious Disease, Cumming School of Medicine, University of Calgary, 3330 Hospital Drive NW,
Calgary, AB T2N 4N1, Canada
Email rsomayaj@ucalgary.ca
* Corresponding author †Co-first authors
References
- Raff AB, Kroshinsky D. Cellulitis: a review. JAMA 2016;316:325–37.
- Brown BD, Hood Watson KL. Cellulitis. Treasure Island (FL): StatPearls Publishing; 2022 [cited 2022 May 31]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK549770/
- Miller LG, Eisenberg DF, Liu H, Chang CL, Wang Y, Luthra R, et al. Incidence of skin and soft tissue infections in ambulatory and inpatient settings, 2005–2010. BMC Infect Dis 2015 Aug 21;15(1).
- Peterson RA, Polgreen LA, Cavanaugh JE, Polgreen PM. Increasing incidence, cost, and seasonality in patients hospitalized for cellulitis. Open Forum Infect Dis 2017 Jan 1;4(1).
- Weng QY, Raff AB, Cohen JM, Gunasekera N, Okhovat JP, Vedak P, et al. Costs and consequences associated with misdiagnosed lower extremity cellulitis. JAMA Dermatol 2017 Feb 1;153(2):141–6.
- Patel M, Lee SI, Akyea RK, Grindlay D, Francis N, Levell NJ, et al. A systematic review showing the lack of diagnostic criteria and tools developed for lower-limb cellulitis. Br J Dermatol 2019;181:1156–65.
- Somayaji R. Approach to skin and soft tissue infections. WCET J 2016;36(2):20–4.
- Shukalek C, Parsons L, Somayaji R. Delving into skin and soft tissue infections (SSTI). Part II: Focus on superficial infections. WCET J 2017 Jul;37(3):20–4.
- Dupuy A, Benchikhi H, Roujeau JC, Bernard P, Vaillant L, Chosidow O, et al. Risk factors for erysipelas of the leg (cellulitis): case-control study. BMJ 1999 Jun 12;318:1591–4.
- Björndóttir S, Gottfredsson M, Thórisdóttir AS, Gunnarsson GB, Ríkardsdóttir H, Kristjánsson M, et al. Risk factors for acute cellulitis of the lower limb: a prospective case-control study. Clin Infect Dis 2005 Nov 15 [cited 2022 Oct 1];41(10):1416–22. Available from: https://pubmed.ncbi.nlm.nih.gov/16231251/
- Sullivan T, de Barra E. Diagnosis and management of cellulitis. Clin Med 2018 Apr 1 [cited 2022 Oct 1];18(2):160. Available from: /pmc/articles/PMC6303460/
- Ellis Simonsen SM, van Orman ER, Hatch BE, Jones SS, Gren LH, Hegmann KT, et al. Cellulitis incidence in a defined population. Epidemiol Infect 2006 Apr;134(2):293–9.
- Jenkins TC, Sabel AL, Sarcone EE, Price CS, Mehler PS, Burman WJ. Skin and soft-tissue infections requiring hospitalization at an academic medical center: opportunities for antimicrobial stewardship. Clin Infect Dis 2010 Oct 15 [cited 2022 Oct 1];51(8):895–903. Available from: https://pubmed.ncbi.nlm.nih.gov/20839951/
- Gunderson CG, Cherry BM, Fisher A. Do patients with cellulitis need to be hospitalized? A systematic review and meta-analysis of mortality rates of inpatients with cellulitis. J Gen Intern Med 2018;33:1553–60.
- Eron LJ, Lipsky BA, Low DE, Nathwani D, Tice AD, Volturo GA. Managing skin and soft tissue infections: expert panel recommendations on key decision points. J Antimicrob Chemother 2003 Nov [cited 2022 Oct 1];52 Suppl 1. Available from: https://pubmed.ncbi.nlm.nih.gov/14662806/
- Fulton R, Doherty L, Gill D. Guidelines on the management of cellulitis in adults. Northern Ireland: CREST; 2005.
- Ki V, Rotstein C. Bacterial skin and soft tissue infections in adults: a review of their epidemiology, pathogenesis, diagnosis, treatment and site of care. Can J Infect Dis Med Microbiol 2008 [cited 2022 Oct 1];19(2):173–84. Available from: https://pubmed.ncbi.nlm.nih.gov/19352449/
- Peterson RA, Polgreen LA, Sewell DK, Polgreen PM. Warmer weather as a risk factor for cellulitis: a population-based investigation. Clin Infect Dis 2017 Oct 1;65(7):1167–73.
- Lin PC, Lin HJ, Guo HR, Chen KT. Epidemiological characteristics of lower extremity cellulitis after a typhoon flood. PLoS One 2013 Jun 13;8(6).
- Habif TP. Cellulitis and erysipelas section of bacterial infections: In: Habif TP. Clinical dermatology: a color guide to diagnosis and therapy. 5th ed. Philadelphia, PA: Mosby; 2010. p. 342–350.
- Pitocco D, Spanu T, di Leo M, Vitiello R, Rizzi A, Tartaglione L, et al. Diabetic foot infections: a comprehensive overview. Eur Rev Med Pharmacol Sci 2019;23(2):26–37.
- Keller EC, Tomecki KJ, Alraies MC. Distinguishing cellulitis from its mimics. Cleve Clin J Med 2012;79:547–52.
- Bailey E, Kroshinsky D. Cellulitis: diagnosis and management. Dermatol Ther 2011;24:229–39.
- Stevens DL, Bisno AL, Chambers HF, Dellinger EP, Goldstein EJC, Gorbach SL, et al. Executive summary: practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis 2014 Jul 15;59(2):147–59.
- Stevens DL, Bryant AE. Streptococcus pyogenes: basic biology to clinical manifestations: impetigo, erysipelas and cellulitis. University of Oklahoma Health Sciences Center; 2016 [cited 2022 May 31]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK333408
- Bystritsky R, Chambers H. Cellulitis and soft tissue infections. Ann Intern Med 2018 Feb 6;168(3):ITC17–31.
- Thomas KS, Crook AM, Nunn AJ, Foster KA, Mason JM, Chalmers JR, et al. Penicillin to prevent recurrent leg cellulitis. N Engl J Med 2013 May 2 [cited 2022 Oct 1];368(18):1695–703. Available from: https://pubmed.ncbi.nlm.nih.gov/23635049/
- Dire DJ, Coppola M, Dwyer DA, Lorette JJ, Karr JL. Prospective evaluation of topical antibiotics for preventing infections in uncomplicated soft-tissue wounds repaired in the ED. Acad Emerg Med 1995 Jan 1 [cited 2022 Oct 1];2(1):4–10. Available from: https://onlinelibrary.wiley.com/doi/full/10.1111/j.1553-2712.1995.tb03070.x
- Webb E, Neeman T, Bowden FJ, Gaida J, Mumford V, Bissett B. Compression therapy to prevent recurrent cellulitis of the leg. New Eng J Med 2020 Aug 13;383(7):630–9.
- Singer AJ, Dagum AB. Current management of acute cutaneous wounds. N Engl J Med 2008 Sep 4 [cited 2022 Oct 1];359(10):1037–46. Available from: https://pubmed.ncbi.nlm.nih.gov/18768947/



