Volume 44 Number 2
Atopic Dermatitis: clinical aspects and treatments
Ryan S Q Geng, R Gary Sibbald
Keywords eczema, risk factors, atopic dermatitis, anti-inflammatory therapies, biologics, lesions, phototherapy, trials
For referencing Geng RSQ, Sibbald RG. Atopic Dermatitis: clinical aspects and treatments. WCET® Journal 2024;44(2):29-36
DOI 10.33235/wcet.44.2.29-36
Abstract
Atopic Dermatitis is the most common eczematous inflammatory skin condition, presenting with lesions that typically appear as poorly demarcated erythematous and scaly papules and plaques. The lesions most commonly occur on flexural surfaces of the knees, elbows, and wrists and are associated with moderate to severe itching. This article focuses on the clinical presentation of atopic dermatitis and treatment options. Other related topics include epidemiology, pathogenesis, risk factors, triggers, and differential diagnoses.
Introduction
Atopic dermatitis (AD), or atopic eczema, is the most common eczematous inflammatory skin condition, with a lifetime prevalence of 15%.1 Although patients of all ages can be affected, onset peaks in infancy, with 90% of cases occurring before 5 years of age.2 Notably, the prevalence of AD has increased two- to threefold over the past 3 decades.3
The pathogenesis of AD is multifactorial and involves a complex interplay between the skin barrier, genetic factors, and environmental exposures. Skin barrier dysfunction can be characterised by increased transepidermal water loss, increased skin pH, or decreased levels of ceramides, humectants, and structural proteins. Other challenges to skin barrier function include aberrant filaggrin (FLG; a protein that binds keratin fibers in epidermis) expression or excess soap usage, which can also increase skin permeability.4 As mast cells and basophils become sensitised to environmental antigens, type I immunoglobulin E-mediated hypersensitivity reaction, cytokine release, and inflammation are triggered, often resulting in intense itching. Scratching of the lesions results in further damage to the skin barrier, referred to as the itch-scratch cycle. Chronically, this can lead to worsening inflammation and lichenification.5
With the physical discomfort and cosmetic appearance of AD lesions, patients can experience significant psychosocial challenges, including social distress, embarrassment, and activity limitation.6 Given the potential impact on quality of life and increasing incidence, this review will focus on the clinical features of AD and available treatment options.
Risk Factors
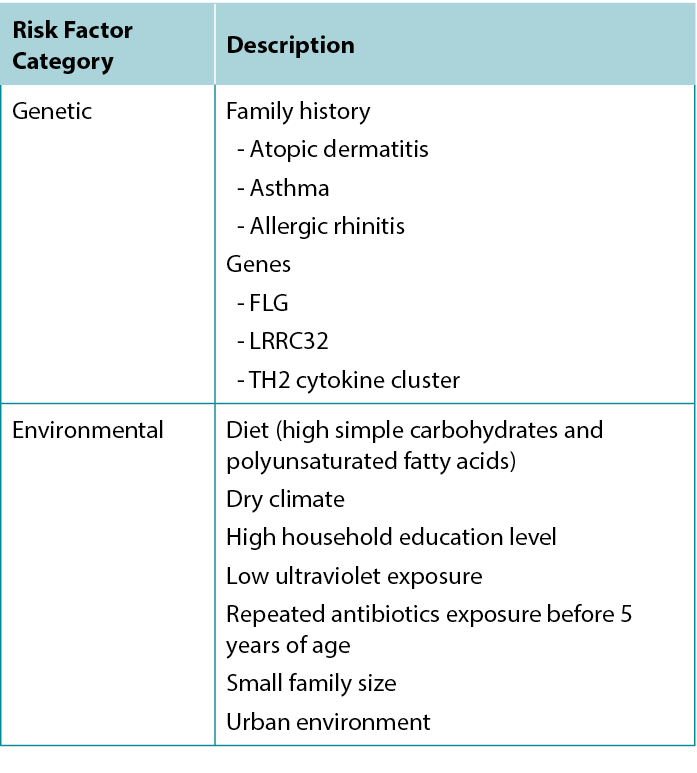
Atopic dermatitis is part of the atopic triad consisting of AD, asthma, and allergic rhinitis. There are several risk factors for developing AD, with the strongest predictor being a positive family history for any atopic disease, especially AD. The implicated genes include FLG, TH2 cytokine cluster, and LRRC32 (which encodes glycoprotein A repetitions predominant).7
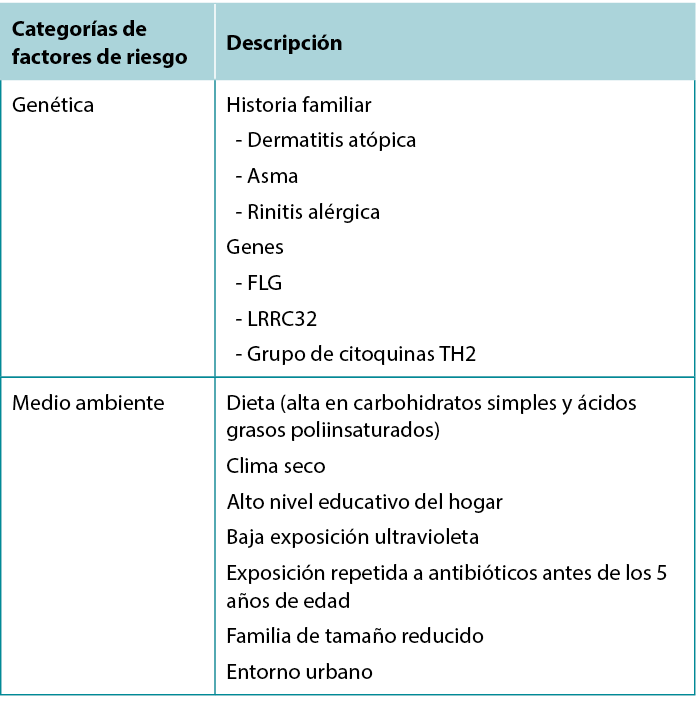
Environmental risk factors have also been identified: Living in an urban environment, dry climate, low UV light exposure, and a diet high in simple carbohydrates and polyunsaturated fatty acids are all associated with increased risk of AD.7 Table 1 summarises risk factors associated with AD.
Table 1 Factors associated with increased risk of developing Atopic Dermatitis.
Clinical classifications
Although the clinical presentation of AD is heterogeneous with various features and symptoms, lesions are typically characterised as poorly demarcated, scaly, and erythematous papules that coalesce into plaques with severe itching that are most commonly found on flexural surfaces of knees, elbows, and wrists. The clinical features of AD are outlined in Table 2, with the essential, major, and minor features being indicated based on American Academy of Dermatology guidelines.2 Because of the wide variation in clinical presentation of AD, there is a broad differential, outlined in Table 3. Classification of AD is based on biomarker serology (IgE), acuity of presentation, and age at onset. Clinical presentations of AD are provided in Figure 1.
Table 2 Features and symptoms of AD.
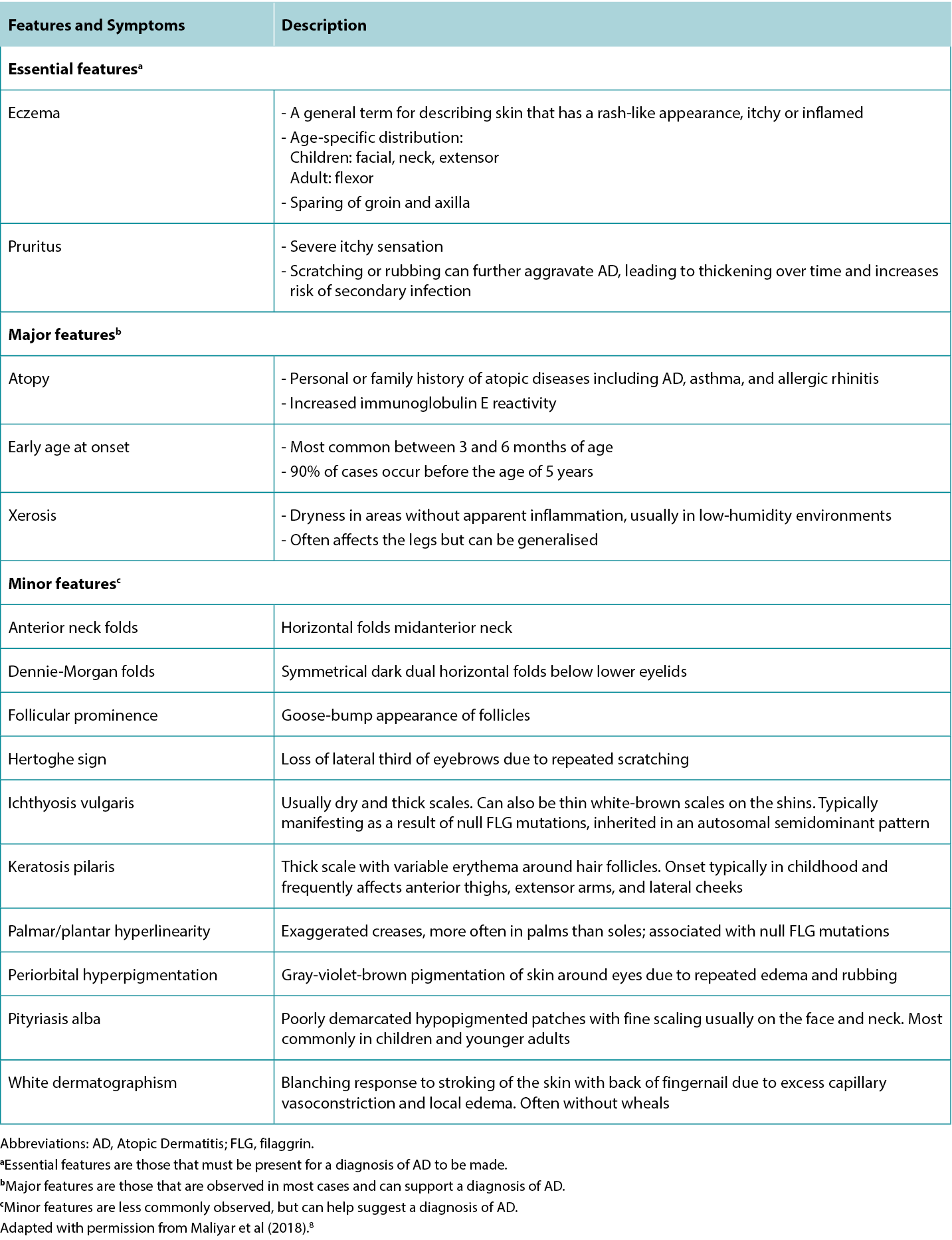
Table 3 Differential diagnoses of Atopic Dermatitis and distinguishing features.

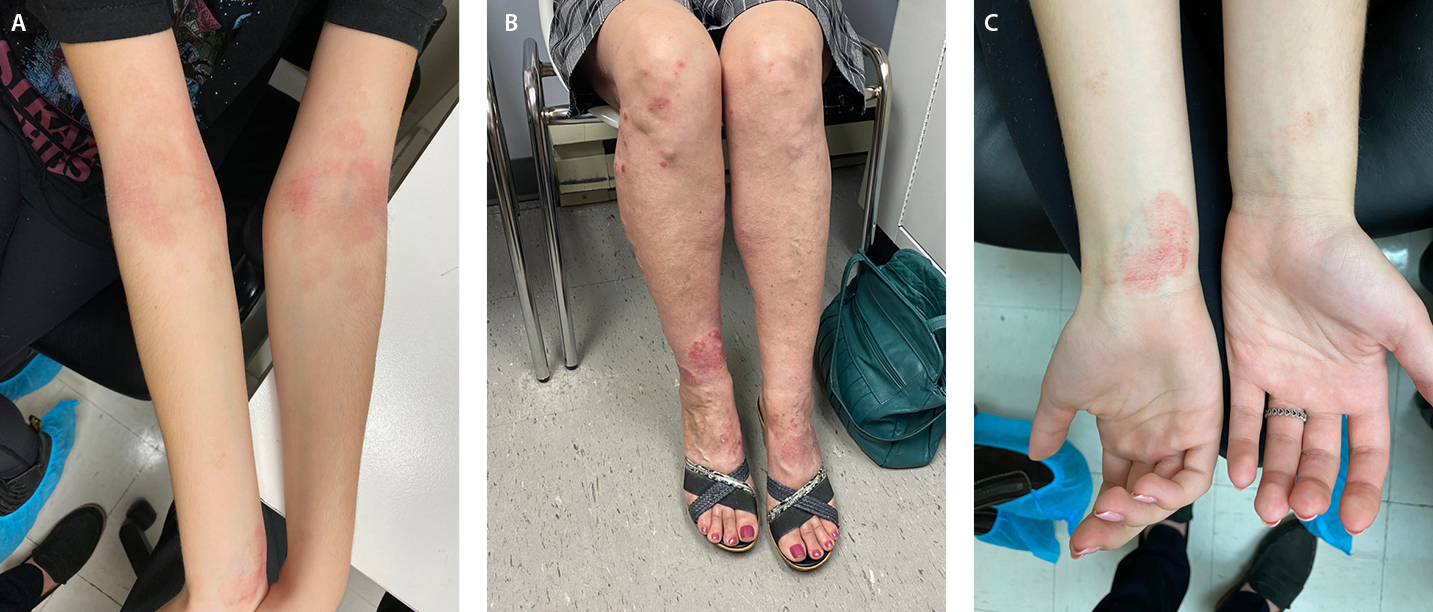
Figure 1 Clinical presentations of Atopic Dermatitis
A, Poorly demarcated erythematous plaques with fine scale on flexural aspect of the elbow. B, Well-demarcated erythematous plaques distributed on the dorsal aspect of the feet, ankle, and below the knee. C, Poorly demarcated erythematous patch on the flexural aspect of the wrist.
Classification by Serum IgE Levels
Extrinsic. The extrinsic subtype is characterised by elevated total IgE levels (>200 kU/L) in response to specific protein allergens, typically from the Dermatophagoides genus of mites, including Dermatophagoides pteronyssinus and Dermatophagoides farina. The main elevated cytokines include interleukin 4 (IL-4), IL-5, and IL-13, characteristic of a TH2 response. The extrinsic subtype arises from impaired skin barrier function, with 20% to 30% of patients having pathogenic FLG variants, and is much more common than the intrinsic subtype.9
Intrinsic. The intrinsic subtype is characterised by normal total IgE levels (<200 kU/L) and shows a sexual predilection toward women. The main elevated cytokine is interferon γ, characteristic of a TH1 response. Although the skin barrier is intact in the intrinsic subtype, metals and haptens can still penetrate the skin and trigger a response.9
Classification by Acuity of Presentation
Individual lesions of AD can be classified based on the acuity of presentation into acute, subacute, or chronic categories. An individual with AD may present with a combination of lesions in any of these different stages.
Acute. Acute lesions appear as poorly demarcated erythematous papulovesicular papules and plaque eruptions with blistering, weeping, and/or crusting. Widespread edema may also be present, with or without scales. Scratching can lead to erosions and pustules that are susceptible to secondary infection, primarily with Staphylococcus aureus.10
Subacute. Subacute lesions appear as poorly demarcated erythematous scaly plaques and papules.10
Chronic. Chronic lesions can involve lichenification (thickening of skin with increased visibility of skin markings) due to repeated scratching over time and scale.10
Classification by Age at Onset
Infantile (2 weeks to 2 years of age). Infantile-onset AD typically presents with lesions characterised as itchy papules and vesicles with associated serous exudate and/or crusting, most commonly affecting the head and neck. Lesions usually first appear as erythema and scaling on the cheeks, which then extend to the forehead, scalp, and neck. Extensor surfaces are also often involved as a result of trauma from crawling. Over time, scratching and rubbing can result in crusting and lichenification (thickening and increased skin surface markings).8
Childhood (2 years of age through puberty). In childhood-onset AD, facial involvement is less prominent, and instead the feet, ankles, wrists, and the flexural aspect of the knees and elbows are more commonly involved. Lesions are typically dry with lichenified plaques, papules, erosions (breakdown of epidermis with epidermal base), and/or crusts.8
Adult (postpuberty). Similar to childhood-onset AD, adult-onset AD primarily involves flexural regions, but also more commonly affects the face and neck. Lesions typically present as symmetrical, dry, scaly plaques, and papules. Excoriations and lichenification are commonly observed, whereas crusting and exudation are less frequent.8
Severity scoring
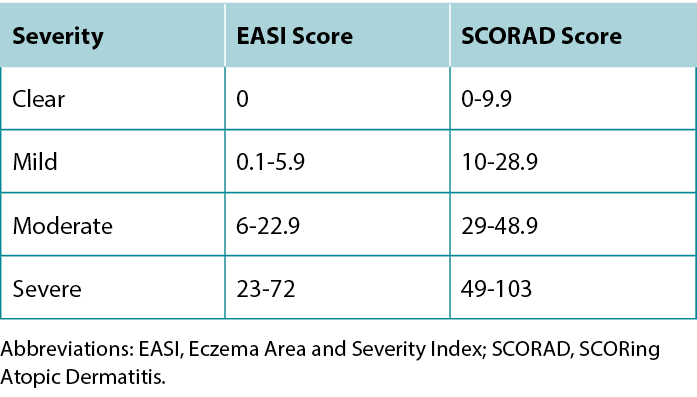
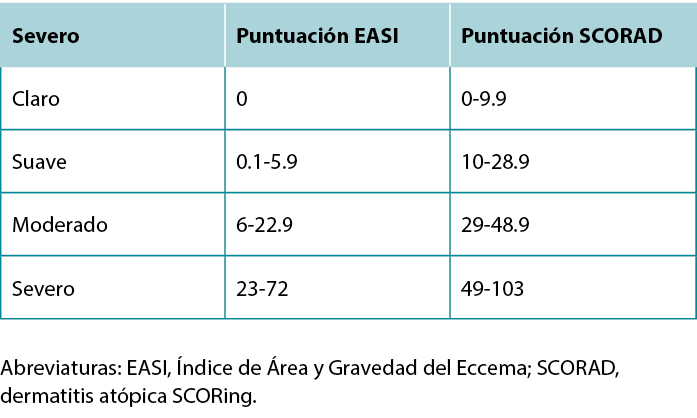
Once a diagnosis of AD has been achieved, describing the severity of the disease can guide treatment selection. The most commonly used severity scoring tools are the Eczema Area and Severity Index (EASI) and SCORing Atopic Dermatitis (SCORAD). Although both tools include the extent of erythema, swelling, excoriation, lichenification, and body area affected, the SCORAD also considers subjective patient measures.11 A summary of the severity grading strata for EASI and SCORAD is provided in Table 4.
Table 4 EASI and SCORAD severity grading strata.
AD treatments
Several treatment options are available for treating AD lesions to provide symptomatic relief for patients and break the itch-scratch cycle to prevent disease progression and development of secondary infection. Counsel patients to regularly use moisturisers with emollients, humectants, and occlusive agents to improve the skin barrier, provide some itch relief, and prevent future flares.12 Patients with AD should avoid products with fragrances to minimise potential exposure to allergens. Discuss the importance of identifying and avoiding factors that trigger or exacerbate AD lesions.13 A list of common trigger factors is provided in Table 5, and a summary of treatment options for AD is provided in Table 6.
Table 5 Triggers and exacerbating factors of Atopic Dermatitis.

Table 6 Treatment options for Atopic Dermatitis.
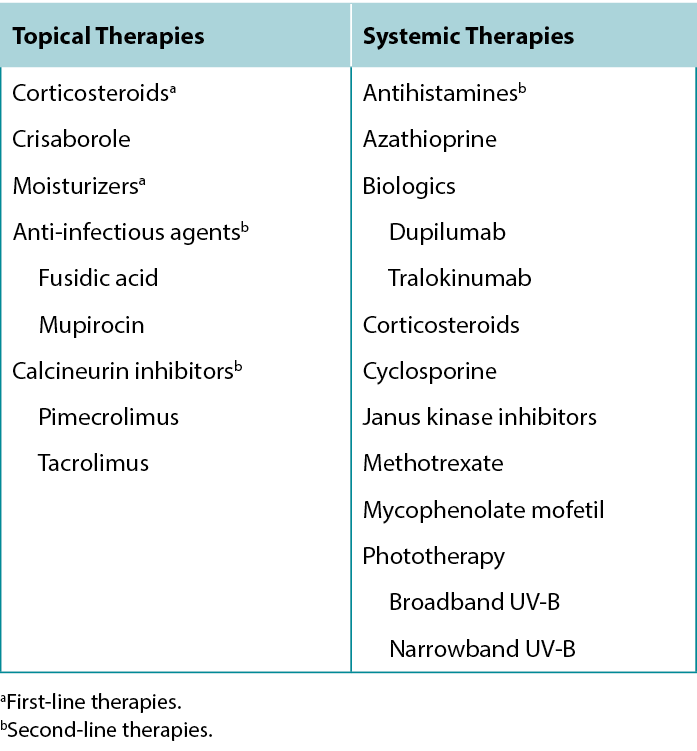
Pharmaceutical Topical Treatments
Topical moisturisers. Regular usage of moisturisers is the cornerstone of AD therapy. Moisturisers can contain a combination of humectants, occlusives, and emollients that help protect the skin barrier. Humectants are hydrophilic substances that hold onto water, occlusives are hydrophobic substances that form a physical layer over the skin to trap water below, and emollients fill spaces between dead skin cells to soften the skin.
In addition to helping patients manage dryness and itchiness of active AD lesions, moisturisers can also prolong relapse. In a trial involving 44 patients with AD lesions cleared by betamethasone 0.1% cream, those who applied an urea-containing moisturising cream as the sole maintenance therapy relapsed after more than 180 days on average, compared with 30 days for patients who did not use any maintenance therapy.14
Topical corticosteroids. Corticosteroids have anti-inflammatory properties that are used for treating acute flares and itchiness. In a trial involving 40 patients, those treated with mometasone furoate 0.1% cream nightly for 4 weeks achieved a 77% reduction in SCORAD score compared with 17% for Vaseline control (P < .001).15 Corticosteroids are classified by their potency, and choice of corticosteroid should be guided by the patient’s age, region of the body affected, and severity of disease. Generally, low-potency corticosteroids are used for milder disease, younger patients, and in areas involving the face and folds (intertriginous regions).8 Long-term topical corticosteroid use is associated with further decreased skin-barrier function, skin atrophy, telangiectasia, and purpura and can induce or aggravate rosacea and perioral dermatitis. As such, corticosteroids are only recommended for short-term treatment of flares and symptom management. Intradermal corticosteroid injections can also be provided to provide fast-acting relief for acute flares.
Topical calcineurin inhibitors (tacrolimus and pimecrolimus). Tacrolimus and pimecrolimus are calcineurin inhibitors with anti-inflammatory properties and skin barrier-preserving properties used in treating AD. In one trial, 49 patients who applied tacrolimus 0.1% ointment twice daily for up to 22 days achieved 72% reduction in EASI score compared with 26% for vehicle (P < .001).16 Unlike corticosteroids, long-term tacrolimus or pimecrolimus use is not associated with skin atrophy; they can be used to reduce corticosteroid load or for maintenance.17 Patients may experience burning or stinging upon application, but cooling the product in the refrigerator prior to application can alleviate this sensation.
Topical phosphodiesterase-4 inhibitors (crisaborole). Crisaborole is a phosphodiesterase-4 inhibitor with efficacy in treating AD through downregulating the production of proinflammatory cytokines. In one study involving 400 patients, those treated with crisaborole 2% ointment twice daily for 4 weeks achieved a mean reduction of 60% in EASI score compared with 43% for vehicle (P = .0002).18 Crisaborole is generally well tolerated and is another steroid-sparing option for treating AD.
Topical anti-infectious agents. Anti-infectious agents are typically used as adjunctive therapies in cases where there is accompanying infection or if it is believed that a microbial factor (eg, S aureus) is aggravating the AD.
Fusidic acid and mupirocin are antibiotics used for targeting staphylococcal and streptococcal bacteria and can be effective in treating AD if S aureus colonisation is a contributing pathogenesis factor. In one trial involving 239 patients, those treated with fusidic acid 2% plus hydrocortisone 1% cream showed significant improvements in factors including erythema, itching, and scaling compared with patients treated with fusidic acid 2% cream or hydrocortisone 1% cream alone (P = .009).19
Soaking with bleach (sodium hypochlorite) is another option for reducing colonisation by S aureus. Patients can mix a quarter to a half cup of 6% bleach solution with a bathtub full of water and soak for 5 to 10 minutes.
Systemic Pharmaceutical Treatments
Corticosteroids. Although corticosteroids can be taken orally, this is often not recommended due to rebound flares on cessation and adverse effects associated with systemic corticosteroid use (eg, weight gain, diabetes, muscle loss, gastrointestinal bleeds, etc). However, systemic corticosteroids may have benefits for treating severe acute flares.20
Calcineurin inhibitors (cyclosporine). Cyclosporine is a calcineurin inhibitor with anti-inflammatory properties that is useful in treating severe or recalcitrant forms of AD that have failed to respond to topic therapy. In one trial involving 46 patients, those who were treated with cyclosporine 5 mg/kg per day for 6 weeks achieved a mean 55% improvement in total body severity assessment score; in contrast, those with placebo worsened by 4% (P = .0002).21 Although cyclosporine offers rapid relief, its effects are not long-lasting, and maintenance therapy is required to prevent relapse.22 Renal impairment is a concern for initiating cyclosporine treatment and must be carefully monitored.
Purine analogs (azathioprine). Azathioprine is a corticosteroid-sparing immunosuppressant used in several inflammatory skin diseases including AD. In a trial involving 37 patients, those treated with azathioprine 2.5 mg/kg per day for 12 weeks reported a mean 26% improvement on factors including erythema, dryness, and lichenification compared with 3% for placebo (P < .01).23 Although azathioprine has similar indications for usage in treating AD as cyclosporine, it is less preferred for acute flares because it does not act as fast. Hepatotoxicity is a concern for initiating azathioprine treatment.
Folic acid inhibitors (methotrexate). Methotrexate has immunosuppressive properties and can be used in low doses to suppress AD symptoms and flares in moderate to severe cases. In a study involving 40 patients, methotrexate was as effective as cyclosporine.24 Patients treated with methotrexate 7.5 mg/wk achieved a mean reduction of 26 SCORAD points compared with a 25-point reduction for those treated with cyclosporine 2.5 mg/kg per day (P = .93).24 Similar to azathioprine, hepatotoxicity should be considered.
Inosine monophosphate dehydrogenase inhibitors (mycophenolate mofetil). Mycophenolate mofetil is another immunosuppressant with efficacy in treating AD. In a pilot study, 10 patients treated with 2 g/d for 4 weeks followed by 1 g/d for 4 weeks achieved a 55% decrease in SCORAD score (P < .01).25 Mycophenolate does not act as fast as corticosteroids or cyclosporine, but it can achieve satisfactory clinical control with fewer adverse effects and be used for maintenance therapy.
Biologics. Currently, the only approved biologics for treating AD are dupilumab and tralokinumab, both of which target the IL-13 signalling pathway. However, many other biologics are in development.
Dupilumab. Dupilumab is an IL-4/IL-13 inhibitor used in treating moderate to severe cases of AD that are recalcitrant to other topical and systemic therapies. In a trial with 671 patients, 38% of patients treated with dupilumab 300 mg subcutaneously every 2 weeks and 37% of those treated weekly for 16 weeks achieved clear or almost clear on the Investigator’s Global Assessment scale compared with 10% for placebo (P < .001).26 Dupilumab greatly improves inflammation and itchiness without dose-limiting toxicity but is an expensive treatment.
Tralokinumab. Tralokinumab is an IL-13 inhibitor with similar indications for use as dupilumab. In a trial with 802 patients, 25% of those treated with tralokinumab 300 mg subcutaneously every 2 weeks for 16 weeks achieved EASI 75 compared with 13% of patients in the control group (P < .001).27 Whereas both tralokinumab and dupilumab are effective, tralokinumab is associated with a lower risk of conjunctivitis.
Janus kinase inhibitors. Janus kinase (JAK) inhibitors are small-molecule inhibitors that target the JAK signalling pathway, which is associated with several proinflammatory cytokines. In a trial involving 560 patients, 80% of those treated with upadacitinib 30 mg daily for 16 weeks achieved EASI 75 compared with 16% for placebo (P < .0001).28 In addition to offering high-target specificity like the biologics, JAK inhibitors can be applied topically (tofacitinib, ruxolitinib, delgocitinib) or taken orally (tofacitinib, baricitinib, abrocitinib, upadacitinib), offering a simpler route of administration.
Currently, three JAK inhibitors have been approved by the US Food and Drug Administration for use in AD. The first was ruxolitinib, a JAK1/2 inhibitor that was approved in 2021. The newer JAK1 selective inhibitors, upadacitinib and abrocitinib, were approved in 2022. Because of the novelty of these agents, their safety information may not be comprehensive, and clinicians should practice extra caution. Janus kinase inhibitors have black box warnings including increased risk of serious infection, malignancy, and lipid level changes. The US Food and Drug Administration added additional black box warnings for JAK inhibitors in 2022 because of an increased risk of adverse cardiovascular events, including heart attack, stroke, and blood clot formation. However, this finding was from a trial studying the incidence of major adverse cardiovascular events in patients over the age of 50 years with rheumatoid arthritis and at least one cardiovascular risk factor being treated with tofacitinib, with nearly 100% of patients taking methotrexate and more than 50% taking prednisone concurrently.29 Although clinicians should always pay close attention to black box warnings, it should be noted that the patient demographics in that study are not representative of AD patients, nor does the treatment regimen represent one that would be used in patients with AD.
Antihistamines. Antihistamines are used as an adjunctive treatment in AD to provide itch relief but do not treat the underlying disease itself. Even so, histamines should be considered in patients experiencing great discomfort due to the itchiness, because breaking the itch-scratch cycle is key to preventing disease progression and complications. This is especially relevant for patients who experience difficulty sleeping, in which case sedating antihistamines can provide relief.30
For relieving itch at night, use first-generation antihistamines (eg, diphenhydramine, hydroxyzine, etc), which provide a sedative effect to aid in sleep. For daytime, it is best to use second-generation antihistamines (eg, cetirizine, bilastine, etc), which are much less sedating because of their diminished ability to cross the blood-brain barrier.
Phototherapy
Phototherapy is another option for patients whose AD cannot be controlled solely with topical therapy or who have extensive bodily involvement. Phototherapy modalities have shown efficacy in treating AD, including broadband UV-B and narrowband UV-B. Narrowband UV-B is considered first-line phototherapy, but its use can be limited by overheating and sweating, which can flare AD.31
Conclusions
Atopic dermatitis is the most common eczematic inflammatory skin condition, and it may reduce patients’ quality of life because of physical discomfort (itching, sleep disturbances) and adverse cosmetic effects. Management of AD often involves a combination of targeting the underlying disease and symptom management to break the itch-scratch cycle to prevent further exacerbation and promote disease remission. This can be achieved through the regular use of moisturisers and avoidance of triggers combined with either topical or systemic therapies.
Practice pearls
- Atopic dermatitis can be classified according to serum IgE levels, age at onset, and time of presentation.
- Atopic dermatitis lesions typically appear as poorly demarcated, scaly, and erythematous plaques associated with severe itching, most commonly found on flexural surfaces of knees, elbows, wrists, and sides of fingers.
- Use of moisturisers with emollient, humectant, or occlusive agents and avoidance of triggers are key to treatment.
- Symptomatic treatment to relieve physical discomfort and break the itch-scratch cycle can improve quality of life and prevent further exacerbation.
- Therapies with anti-inflammatory properties are the cornerstone of ad treatment.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Dermatitis atópica: aspectos clínicos y tratamientos
Ryan S Q Geng, R Gary Sibbald
DOI: 10.33235/wcet.44.2.29-36
Resumen
La dermatitis atópica es la enfermedad inflamatoria eccematosa de la piel más frecuente, y se presenta con lesiones que suelen aparecer como pápulas y placas eritematosas y escamosas mal delimitadas. Las lesiones se producen con mayor frecuencia en las superficies de flexión de las rodillas, los codos y las muñecas, y se asocian a picor de moderado a intenso. Este artículo se centra en la presentación clínica de la dermatitis atópica y las opciones de tratamiento. Otros temas relacionados son la epidemiología, la patogénesis, los factores de riesgo, los desencadenantes y los diagnósticos diferenciales.
Introducción
La dermatitis atópica (AD), o eccema atópico, es la enfermedad inflamatoria eccematosa de la piel más frecuente, con una prevalencia a lo largo de la vida del 15%.1 Aunque puede afectar a pacientes de todas las edades, su aparición alcanza su punto álgido en la infancia, con un 90% de los casos antes de los 5 años.2 Cabe destacar que la prevalencia de la AD se ha multiplicado por dos o por tres en las últimas 3 décadas.3
La patogénesis de la AD es multifactorial e implica una compleja interacción entre la barrera cutánea, factores genéticos y exposiciones ambientales. La disfunción de la barrera cutánea puede caracterizarse por un aumento de la pérdida transepidérmica de agua, un aumento del pH cutáneo o una disminución de los niveles de ceramidas, humectantes y proteínas estructurales. Otros problemas que afectan a la función de barrera de la piel son la expresión aberrante de filagrina (FLG; una proteína que une las fibras de queratina de la epidermis) o el uso excesivo de jabón, que también pueden aumentar la permeabilidad de la piel.4 Cuando los mastocitos y los basófilos se sensibilizan a los antígenos ambientales, se desencadenan una reacción de hipersensibilidad mediada por inmunoglobulina E de tipo I, la liberación de citocinas y la inflamación, que a menudo provoca un picor intenso. Al rascarse las lesiones, la barrera cutánea se daña aún más, lo que se conoce como el ciclo picor-rascado. Crónicamente, esto puede conducir a un empeoramiento de la inflamación y la liquenificación.5
Además de las molestias físicas y el aspecto estético de las lesiones de la AD, los pacientes pueden experimentar importantes retos psicosociales, como angustia social, vergüenza y limitación de la actividad.6 Dado el impacto potencial sobre la calidad de vida y la creciente incidencia, esta revisión se centrará en las características clínicas de la AD y las opciones de tratamiento disponibles.
Factores de riesgo
La dermatitis atópica forma parte de la tríada atópica formada por la AD, el asma y la rinitis alérgica. Existen varios factores de riesgo para desarrollar AD, siendo el más importante los antecedentes familiares positivos de cualquier enfermedad atópica, especialmente la AD. Los genes implicados incluyen el FLG, el grupo de citocinas TH2 y el LRRC32 (que codifica la glicoproteína A repeticiones predominante).7
También se han identificado factores de riesgo ambientales: Vivir en un entorno urbano, un clima seco, una baja exposición a la luz ultravioleta y una dieta rica en hidratos de carbono simples y ácidos grasos poliinsaturados se asocian a un mayor riesgo de AD.7 La tabla 1 resume los factores de riesgo asociados a la AD.
Tabla 1 Factores asociados a un mayor riesgo de desarrollar dermatitis atópica.
Clasificaciones clinicas
Aunque la presentación clínica de la AD es heterogénea con diversos rasgos y síntomas, las lesiones se caracterizan típicamente por ser pápulas mal delimitadas, escamosas y eritematosas que confluyen en placas con picor intenso que se encuentran con mayor frecuencia en las superficies de flexión de rodillas, codos y muñecas. Las características clínicas de la AD se describen en la tabla 2, indicándose las características esenciales, principales y secundarias en función de las directrices de la Academia Americana de Dermatología.2 Debido a la amplia variación en la presentación clínica de la AD, existe un amplio diferencial, que se describe en la tabla 3. La clasificación de la AD se basa en la serología de los biomarcadores (IgE), la agudeza de la presentación y la edad de inicio. En la figura 1 se muestran las presentaciones clínicas de la AD.
Tabla 2 Características y síntomas de la AD.
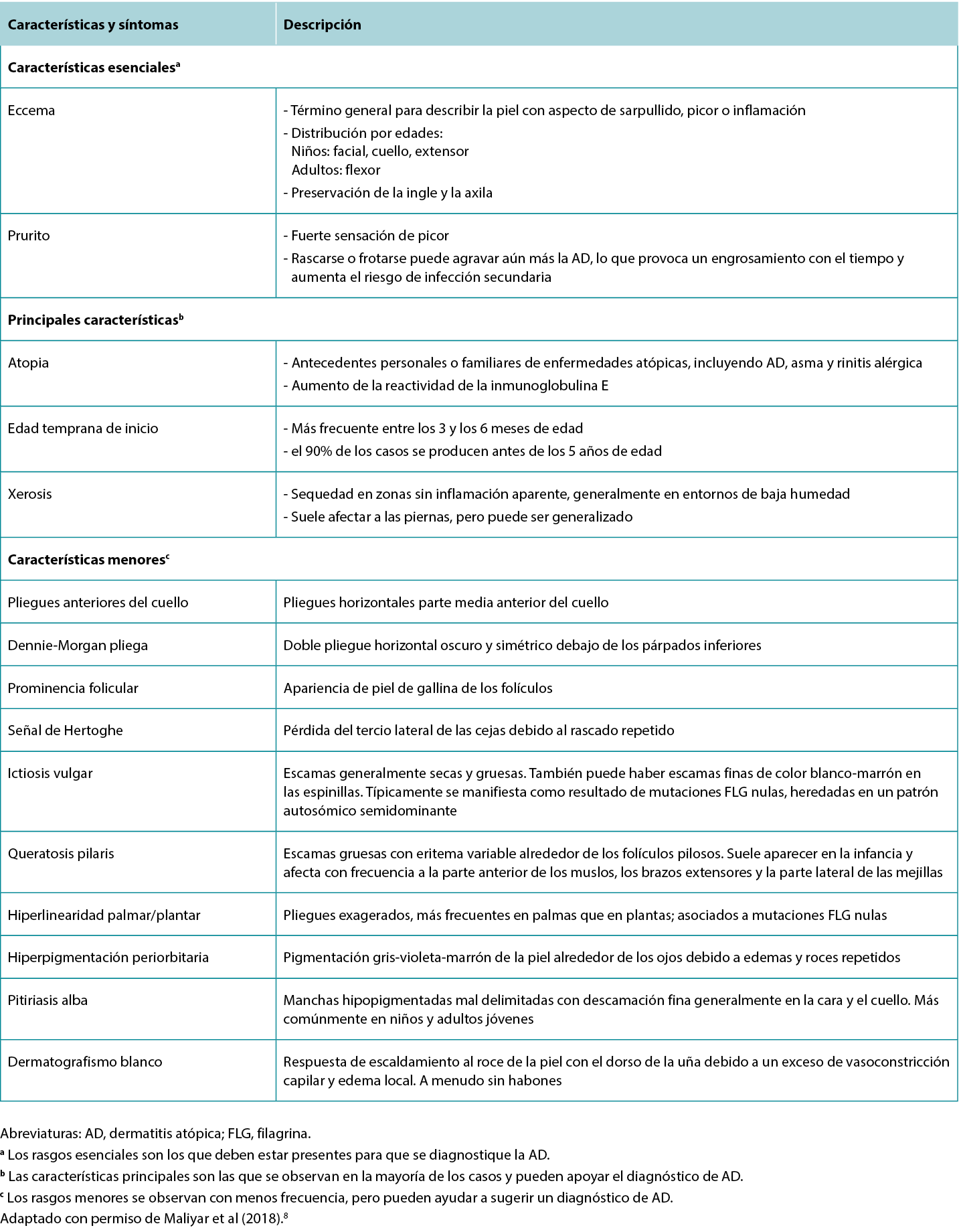
Tabla 3 Diagnósticos diferenciales de la dermatitis atópica y características distintivas.


Figura 1 Presentaciones clínicas de la dermatitis atópica
A, placas eritematosas mal delimitadas con escamas finas en la cara flexural del codo. B, Placas eritematosas bien delimitadas distribuidas en la cara dorsal de los pies, tobillo y debajo de la rodilla. C, Mancha eritematosa mal delimitada en la cara flexural de la muñeca.
Clasificación según los niveles séricos de IgE
Extrínseca. El subtipo extrínseco se caracteriza por niveles elevados de IgE total (>200 kU/L) en respuesta a alérgenos proteicos específicos, normalmente del género de ácaros Dermatophagoides , incluidos Dermatophagoides pteronyssinus y Dermatophagoides farina. Las principales citocinas elevadas incluyen la interleucina 4 (IL-4), la IL-5 y la IL-13, características de una respuesta TH2. El subtipo extrínseco se debe a una alteración de la función de barrera de la piel; entre el 20% y el 30% de los pacientes presentan variantes patógenas de FLG, y es mucho más frecuente que el subtipo intrínseco.9
Intrínseca. El subtipo intrínseco se caracteriza por niveles normales de IgE total (<200 kU/L) y muestra una predilección sexual hacia las mujeres. La principal citocina elevada es el interferón γ, característico de una respuesta TH1. Aunque la barrera cutánea está intacta en el subtipo intrínseco, los metales y los haptenos pueden penetrar en la piel y desencadenar una respuesta.9
Clasificación por agudeza de presentación
Las lesiones individuales de la AD pueden clasificarse en función de la agudeza de la presentación en categorías agudas, subagudas o crónicas. Un individuo con AD puede presentar una combinación de lesiones en cualquiera de estas diferentes etapas.
Aguda. Las lesiones agudas aparecen como pápulas eritematosas mal delimitadas y erupciones en placas con ampollas, exudado y/o costras. También puede haber edema generalizado, con o sin escamas. El rascado puede provocar erosiones y pústulas susceptibles de infección secundaria, principalmente por Staphylococcus aureus.10
Subaguda. Las lesiones subagudas aparecen como placas y pápulas eritematosas escamosas mal delimitadas.10
Crónica. Las lesiones crónicas pueden implicar liquenificación (engrosamiento de la piel con aumento de la visibilidad de las marcas cutáneas) debido al rascado repetido a lo largo del tiempo y a la descamación.10
Clasificación por edad de inicio
Infantil (de 2 semanas a 2 años de edad). La AD de inicio infantil suele presentarse con lesiones caracterizadas por pápulas y vesículas pruriginosas con exudado seroso asociado y/o costras, que afectan con mayor frecuencia a la cabeza y el cuello. Las lesiones suelen aparecer primero como eritema y descamación en las mejillas, que luego se extienden a la frente, el cuero cabelludo y el cuello. Las superficies extensoras también se ven afectadas a menudo como consecuencia de traumatismos provocados por el gateo. Con el tiempo, el rascado y el roce pueden producir costras y liquenificación (engrosamiento y aumento de las marcas en la superficie de la piel).8
Infancia (desde los 2 años hasta la pubertad). En la AD de inicio en la infancia, la afectación facial es menos prominente y, en cambio, los pies, los tobillos, las muñecas y el aspecto flexural de las rodillas y los codos se ven afectados con mayor frecuencia. Las lesiones suelen ser secas, con placas liquenificadas, pápulas, erosiones (ruptura de la epidermis con la base epidérmica) y/o costras.8
Adulto (pospubertad). De forma similar a la AD de inicio en la infancia, la AD de inicio en la edad adulta afecta principalmente a las regiones flexurales, pero también es más frecuente que afecte a la cara y el cuello. Las lesiones suelen presentarse como placas y pápulas simétricas, secas y escamosas. Suelen observarse excoriaciones y liquenificación, mientras que las costras y la exudación son menos frecuentes.8
Puntuacion de la gravedad
Una vez diagnosticada la AD, la descripción de la gravedad de la enfermedad puede orientar la selección del tratamiento. Las herramientas de puntuación de gravedad más utilizadas son el Índice de área y gravedad del eccema (EASI) y el SCORing dermatitis atópica (SCORAD). Aunque ambas herramientas incluyen la extensión del eritema, la inflamación, la excoriación, la liquenificación y el área corporal afectada, el SCORAD también tiene en cuenta las medidas subjetivas del paciente.11 En la tabla 4 se ofrece un resumen de los estratos de gradación de la gravedad para el EASI y el SCORAD.
Tabla 4 Estratos de clasificación de la gravedad según EASI y SCORAD.
Tratamientos de lal ad
Existen varias opciones terapéuticas para tratar las lesiones de AD con el fin de proporcionar alivio sintomático a los pacientes y romper el ciclo de picor-rascado para evitar la progresión de la enfermedad y el desarrollo de una infección secundaria. Aconsejar a los pacientes que utilicen regularmente cremas hidratantes con emolientes, humectantes y agentes oclusivos para mejorar la barrera cutánea, proporcionar cierto alivio del picor y prevenir futuros brotes.12 Los pacientes con AD deben evitar los productos con fragancias para minimizar la posible exposición a alérgenos. Discuta la importancia de identificar y evitar los factores que desencadenan o exacerban las lesiones de la AD.13 En la Tabla 5 se ofrece una lista de factores desencadenantes comunes, y en la Tabla 6 un resumen de las opciones de tratamiento para la AD.
Tabla 5 Factores desencadenantes y exacerbantes de la dermatitis atópica.
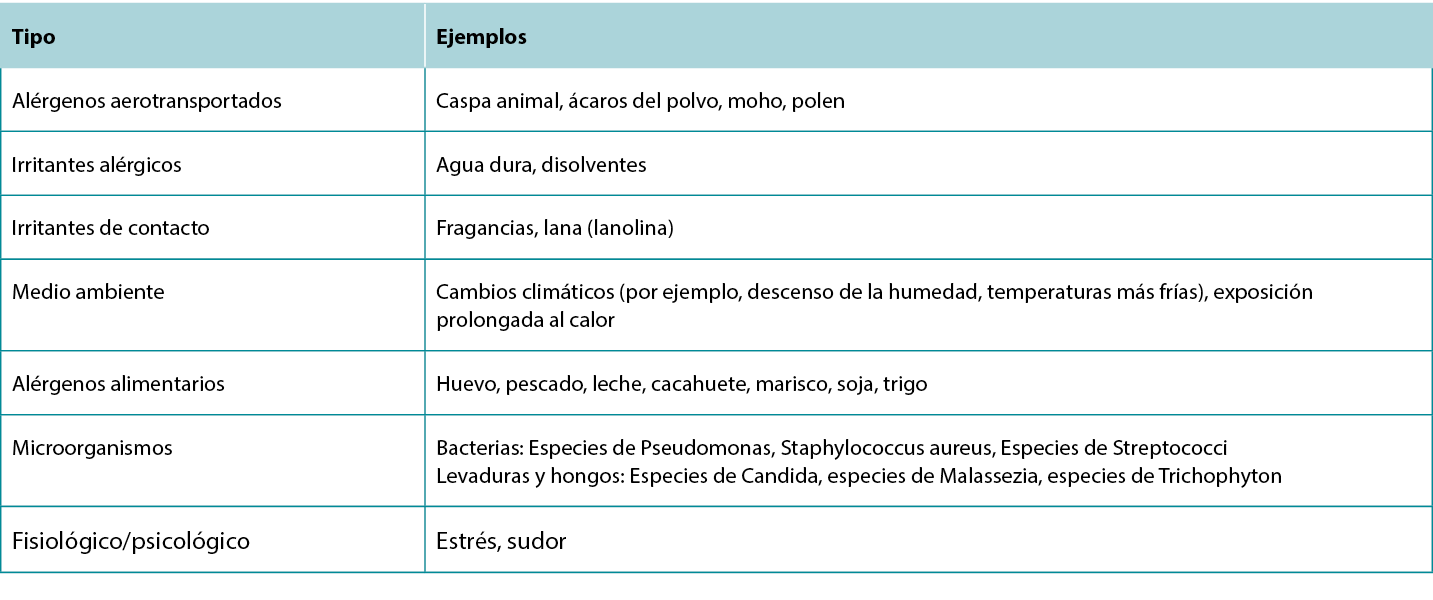
Tabla 6 Opciones de tratamiento para la dermatitis atópica.

Tratamientos tópicos farmacéuticos
Humectantes tópicos. El uso regular de cremas hidratantes es la piedra angular del tratamiento de la AD. Las cremas hidratantes pueden contener una combinación de humectantes, oclusivos y emolientes que ayudan a proteger la barrera cutánea. Los humectantes son sustancias hidrófilas que retienen el agua, los oclusivos son sustancias hidrófobas que forman una capa física sobre la piel para atrapar el agua que hay debajo, y los emolientes rellenan los espacios entre las células muertas de la piel para suavizarla.
Además de ayudar a los pacientes a controlar la sequedad y el picor de las lesiones activas de la AD, los humectantes también pueden prolongar la recaída. En un ensayo en el que participaron 44 pacientes con lesiones de AD aclaradas con crema de betametasona al 0.1%, los que se aplicaron una crema hidratante que contenía urea como único tratamiento de mantenimiento recayeron al cabo de más de 180 días de media, en comparación con los 30 días de los pacientes que no utilizaron ningún tratamiento de mantenimiento.14
Corticosteroides tópicos. Los corticosteroides tienen propiedades antiinflamatorias que se utilizan para tratar los brotes agudos y el picor. En un ensayo que involucró a 40 pacientes, los tratados con crema de mometasona de furoato al 0.1% todas las noches durante 4 semanas lograron una reducción del 77% en la puntuación SCORAD en comparación con el 17% para el control de vaselina (P<0.001).15 Los corticosteroides se clasifican por su potencia, y la elección del corticosteroide debe guiarse por la edad del paciente, la región del cuerpo afectada y la gravedad de la enfermedad. Por lo general, los corticosteroides de baja potencia se utilizan para la enfermedad más leve, en pacientes jóvenes y en zonas que afectan a la cara y los pliegues (regiones intertriginosas).8 El uso prolongado de corticosteroides tópicos se asocia a una mayor disminución de la función de barrera de la piel, atrofia cutánea, telangiectasia y púrpura, y puede inducir o agravar la rosácea y la dermatitis perioral. Por ello, los corticosteroides sólo se recomiendan para el tratamiento a corto plazo de los brotes y el control de los síntomas. También pueden administrarse inyecciones intradérmicas de corticosteroides para aliviar rápidamente los brotes agudos.
Inhibidores tópicos de la calcineurina (tacrolimus y pimecrolimus). El tacrolimus y el pimecrolimus son inhibidores de la calcineurina con propiedades antiinflamatorias y de preservación de la barrera cutánea utilizados en el tratamiento de la AD. En un ensayo, 49 pacientes que se aplicaron una pomada de tacrolimus al 0.1% dos veces al día durante un máximo de 22 días consiguieron una reducción del 72% en la puntuación del EASI, en comparación con el 26% del vehículo (P<0.001).16 A diferencia de los corticosteroides, el uso a largo plazo de tacrolimus o pimecrolimus no se asocia a atrofia cutánea; pueden utilizarse para reducir la carga de corticosteroides o para mantenimiento.17 Los pacientes pueden experimentar ardor o escozor en el momento de la aplicación, pero enfriar el producto en el frigorífico antes de aplicarlo puede aliviar esta sensación.
Inhibidores tópicos de la fosfodiesterasa-4 (crisaborol). El crisaborol es un inhibidor de la fosfodiesterasa-4 eficaz en el tratamiento de la AD que reduce la producción de citoquinas proinflamatorias. En un estudio en el que participaron 400 pacientes, los tratados con una pomada de crisaborol al 2% dos veces al día durante 4 semanas lograron una reducción media del 60% en la puntuación del EASI en comparación con el 43% del vehículo (P=0.0002).18 El crisaborol suele tolerarse bien y es otra opción que ahorra esteroides para el tratamiento de la AD.
Agentes antiinfecciosos tópicos. Los agentes antiinfecciosos suelen utilizarse como terapias complementarias en los casos en que existe una infección acompañante o si se cree que un factor microbiano (por ejemplo, S aureus) está agravando la AD.
El ácido fusídico y la mupirocina son antibióticos que se utilizan contra las bacterias estafilocócicas y estreptocócicas y pueden ser eficaces en el tratamiento de la AD si la colonización por S. aureus es un factor patogénico contribuyente. En un ensayo en el que participaron 239 pacientes, los tratados con ácido fusídico al 2% más crema de hidrocortisona al 1% mostraron mejoras significativas en factores como el eritema, el prurito y la descamación, en comparación con los pacientes tratados sólo con crema de ácido fusídico al 2% o crema de hidrocortisona al 1% (P= 0.009).19
El remojo con lejía (hipoclorito sódico) es otra opción para reducir la colonización por S aureus. Los pacientes pueden mezclar entre un cuarto y media taza de solución de lejía al 6% con una bañera llena de agua y dejarla en remojo de 5 a 10 minutos.
Tratamientos farmacéuticos sistémicos
Corticosteroides. Aunque los corticosteroides pueden tomarse por vía oral, a menudo no se recomienda debido a los brotes de rebote al dejar de tomarlos y a los efectos adversos asociados al uso de corticosteroides sistémicos (p. ej., aumento de peso, diabetes, pérdida muscular, hemorragias gastrointestinales, etc.). Sin embargo, los corticosteroides sistémicos pueden ser beneficiosos para tratar los brotes agudos graves.20
Inhibidores de la calcineurina (ciclosporina). La ciclosporina es un inhibidor de la calcineurina con propiedades antiinflamatorias que resulta útil en el tratamiento de las formas graves o recalcitrantes de la AD que no han respondido al tratamiento tópico. En un ensayo en el que participaron 46 pacientes, los que fueron tratados con ciclosporina 5 mg/kg al día durante 6 semanas lograron una mejoría media del 55% en la puntuación total de la evaluación de la gravedad corporal; por el contrario, los que recibieron placebo empeoraron un 4%(P=0.0002).21 Aunque la ciclosporina ofrece un alivio rápido, sus efectos no son duraderos, y se requiere un tratamiento de mantenimiento para evitar recaídas.22 La insuficiencia renal es un motivo de preocupación al iniciar el tratamiento con ciclosporina y debe vigilarse cuidadosamente.
Análogos de las purinas (azatioprina). La azatioprina es un inmunosupresor ahorrador de corticosteroides que se utiliza en varias enfermedades inflamatorias de la piel, incluida la AD. En un ensayo en el que participaron 37 pacientes, los tratados con 2.5 mg/kg de azatioprina al día durante 12 semanas informaron de una mejoría media del 26% en factores como eritema, sequedad y liquenificación, en comparación con el 3% para el placebo(P<0.01).23 Aunque la azatioprina tiene indicaciones de uso similares a las de la ciclosporina en el tratamiento de la AD, es menos preferible para los brotes agudos porque no actúa con la misma rapidez. La hepatotoxicidad es un motivo de preocupación al iniciar el tratamiento con azatioprina.
Inhibidores del ácido fólico (metotrexato). El metotrexato tiene propiedades inmunosupresoras y puede utilizarse en dosis bajas para suprimir los síntomas y los brotes de AD en los casos moderados a graves. En un estudio en el que participaron 40 pacientes, el metotrexato fue tan eficaz como la ciclosporina.24 Los pacientes tratados con metotrexato 7.5 mg/semana lograron una reducción media de 26 puntos SCORAD en comparación con una reducción de 25 puntos para los tratados con ciclosporina 2.5 mg/kg
al día(P=0.93).24 De forma similar a la azatioprina, debe tenerse en cuenta la hepatotoxicidad.
Inhibidores de la inosina monofosfato deshidrogenasa (micofenolato mofetilo). El micofenolato mofetilo es otro inmunosupresor eficaz en el tratamiento de la AD. En un estudio piloto, 10 pacientes tratados con 2 g/d durante 4 semanas seguidos de 1 g/d durante 4 semanas lograron una disminución del 55% en la puntuación SCORAD (P<0.01).25 El micofenolato no actúa tan rápido como los corticosteroides o la ciclosporina, pero puede lograr un control clínico satisfactorio con menos efectos adversos y utilizarse como tratamiento de mantenimiento.
Biológicos. Actualmente, los únicos fármacos biológicos aprobados para tratar la AD son dupilumab y tralokinumab, ambos dirigidos contra la vía de señalización de la IL-13. Sin embargo, se están desarrollando muchos otros productos biológicos.
Dupilumab. Dupilumab es un inhibidor de la IL-4/IL-13 utilizado en el tratamiento de casos moderados a graves de AD recalcitrantes a otras terapias tópicas y sistémicas. En un ensayo con 671 pacientes, el 38% de los pacientes tratados con dupilumab 300 mg por vía subcutánea cada 2 semanas y el 37% de los tratados semanalmente durante 16 semanas obtuvieron un resultado claro o casi claro en la escala de evaluación global del investigador, en comparación con el 10% para el placebo (P<0.001).26 Dupilumab mejora mucho la inflamación y el picor sin toxicidad limitante de la dosis, pero es un tratamiento caro.
Tralokinumab. Tralokinumab es un inhibidor de la IL-13 con indicaciones de uso similares a las de dupilumab. En un ensayo con 802 pacientes, el 25% de los tratados con tralokinumab 300 mg por vía subcutánea cada 2 semanas durante 16 semanas alcanzaron un EASI 75 en comparación con el 13% de los pacientes del grupo de control (P<0.001).27 Aunque tanto tralokinumab como dupilumab son eficaces, tralokinumab se asocia a un menor riesgo de conjuntivitis.
Inhibidores de la cinasa Janus. Los inhibidores de la Janus quinasa (JAK) son pequeñas moléculas que actúan sobre la vía de señalización JAK, asociada a varias citocinas proinflamatorias. En un ensayo en el que participaron 560 pacientes, el 80% de los tratados con upadacitinib 30 mg al día durante 16 semanas alcanzaron un EASI 75, frente al 16% tratados con placebo (P<0.0001).28 Además de ofrecer una alta especificidad de diana como los biológicos, los inhibidores de JAK pueden aplicarse por vía tópica (tofacitinib, ruxolitinib, delgocitinib) o administrarse por vía oral (tofacitinib, baricitinib, abrocitinib, upadacitinib), lo que ofrece una vía de administración más sencilla.
En la actualidad, la Administración de Alimentos y Medicamentos de US. ha aprobado el uso de tres inhibidores de JAK en la AD. El primero fue el ruxolitinib, un inhibidor de JAK1/2 que se aprobó en 2021. Los nuevos inhibidores selectivos de JAK1, upadacitinib y abrocitinib, se aprobaron en 2022. Debido a la novedad de estos agentes, es posible que la información sobre su seguridad no sea completa, por lo que los médicos deben extremar las precauciones. Los inhibidores de la Janus quinasa tienen advertencias de recuadro negro que incluyen un mayor riesgo de infecciones graves, neoplasias malignas y cambios en los niveles de lípidos. En 2022, la Administración de Alimentos y Medicamentos de US. añadió advertencias adicionales en el recuadro negro de los inhibidores de la JAK debido a un mayor riesgo de acontecimientos cardiovasculares adversos, como infarto de miocardio, accidente cerebrovascular y formación de coágulos sanguíneos. Sin embargo, este resultado procedía de un ensayo que estudiaba la incidencia de acontecimientos cardiovasculares adversos graves en pacientes mayores de 50 años con artritis reumatoide y al menos un factor de riesgo cardiovascular tratados con tofacitinib, en el que casi el 100% de los pacientes tomaban metotrexato y más del 50% prednisona al mismo tiempo.29 Aunque los médicos siempre deben prestar mucha atención a las advertencias de los recuadros negros, hay que señalar que los datos demográficos de los pacientes de ese estudio no son representativos de los pacientes con AD, ni el régimen de tratamiento representa el que se utilizaría en pacientes con AD.
Antihistamínicos. Los antihistamínicos se utilizan como tratamiento complementario en la AD para aliviar el picor, pero no tratan la enfermedad subyacente en sí. Aun así, las histaminas deben considerarse en pacientes que experimentan grandes molestias debido al picor, ya que romper el ciclo picor-rascado es clave para prevenir la progresión de la enfermedad y las complicaciones. Esto es especialmente relevante para los pacientes que experimentan dificultades para dormir, en cuyo caso los antihistamínicos sedantes pueden proporcionar alivio.30
Para aliviar el picor por la noche, utilice antihistamínicos de primera generación (por ejemplo, difenhidramina, hidroxizina, etc.), que proporcionan un efecto sedante que ayuda a conciliar el sueño. Durante el día, es mejor utilizar antihistamínicos de segunda generación (por ejemplo, cetirizina, bilastina, etc.), que son mucho menos sedantes debido a su menor capacidad para atravesar la barrera hematoencefálica.
Fototerapia
La fototerapia es otra opción para los pacientes cuya AD no puede controlarse únicamente con terapia tópica o que presentan una afectación corporal extensa. Las modalidades de fototerapia han demostrado su eficacia en el tratamiento de la AD, incluidas la UV-B de banda ancha y la UV-B de banda estrecha. La UV-B de banda estrecha se considera la fototerapia de primera línea, pero su uso puede verse limitado por el sobrecalentamiento y la sudoración, que pueden exacerbar la AD.31
Conclusiones
La dermatitis atópica es la afección cutánea inflamatoria eccemátosa más frecuente, y puede reducir la calidad de vida de los pacientes debido a las molestias físicas (picor, trastornos del sueño) y los efectos cosméticos adversos. El tratamiento de la AD suele consistir en una combinación de tratamiento de la enfermedad subyacente y de tratamiento de los síntomas para romper el ciclo de picor-rascado, prevenir nuevas exacerbaciones y promover la remisión de la enfermedad. Esto puede conseguirse mediante el uso regular de cremas hidratantes y evitando los desencadenantes, combinados con terapias tópicas o sistémicas.
Perlas de la practica
- La dermatitis atópica puede clasificarse en función de los niveles séricos de IgE, la edad de inicio y el momento de presentación.
- Las lesiones de la dermatitis atópica suelen aparecer como placas mal delimitadas, escamosas y eritematosas, asociadas a un intenso picor, que se localizan con mayor frecuencia en las superficies de flexión de rodillas, codos, muñecas y laterales de los dedos.
- El uso de cremas hidratantes con agentes emolientes, humectantes u oclusivos y la evitación de factores desencadenantes son claves para el tratamiento.
- El tratamiento sintomático para aliviar las molestias físicas y romper el ciclo de picor-rascado puede mejorar la calidad de vida y prevenir nuevas exacerbaciones.
- Las terapias con propiedades antiinflamatorias son la piedra angular del tratamiento de la AD.
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Financiación
Los autores no recibieron financiación por este estudio.
Author(s)
Ryan S Q Geng*
MSc
Temerty School of Medicine, University of Toronto, Toronto, Ontario, Canada
R Gary Sibbald
MD Med FRCPC (Med Derm) FAAD MAPWCA JM
Dalla Lana School of Public Health & Division of Dermatology,
Department of Medicine, University of Toronto
* Corresponding author
References
- Deckers IA, McLean S, Linssen S, Mommers M, van Schayck CP, Sheikh A. Investigating international time trends in the incidence and prevalence of atopic eczema 1990-2010: a systematic review of epidemiological studies. PLoS One 2012;7(7):e39803.
- Eichenfield LF, Tom WL, Chamlin SL, et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol 2014;70(2):338-51.
- Asher MI, Montefort S, Bjorksten B, et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC phases one and three repeat multicountry cross-sectional surveys. Lancet 2006;368(9537):733-43.
- O’Regan GM, Sandilands A, McLean WHI, Irvine AD. Filaggrin in atopic dermatitis. J Allergy Clin Immunol 2008;122(4):689-93.
- Perkin MR, Strachan DP, Williams HC, Kennedy CT, Golding J, Team AS. Natural history of atopic dermatitis and its relationship to serum total immunoglobulin E in a population-based birth cohort study. Pediatr Allergy Immunol 2004;15(3):221-9.
- Gochnauer H, Valdes-Rodriguez R, Cardwell L, Anolik RB. The psychosocial impact of atopic dermatitis. Adv Exp Med Biol 2017;1027:57-69.
- Weidinger S, Beck LA, Bieber T, Kabashima K, Irvine AD. Atopic dermatitis. Nat Rev Dis Primers 2018;4(1):1.
- Maliyar K, Sibbald C, Pope E, Sibbald GR. Diagnosis and management of atopic dermatitis: a review. Adv Skin Wound Care 2018;31(12):538-50.
- Tokura Y, Hayano S. Subtypes of atopic dermatitis: from phenotype to endotype. Allergol Int 2022;71(1):14-24.
- Wolff K, Johnson RA, Saavedra AP, Roh EK. Atopic dermatitis. Fitzpatrick’s Color Atlas and Synopsis of Clinical Dermatology. New York: McGraw-Hill Education; 2017:34-40.
- Chopra R, Vakharia PP, Sacotte R, et al. Severity strata for Eczema Area and Severity Index (EASI), modified EASI, Scoring Atopic Dermatitis (SCORAD), objective SCORAD, Atopic Dermatitis Severity Index and body surface area in adolescents and adults with atopic dermatitis. Br J Dermatol 2017;177(5):1316-21.
- Ellis C, Luger T, Abeck D, et al. International Consensus Conference on Atopic Dermatitis II (ICCAD II): clinical update and current treatment strategies. Br J Dermatol 2003;148 Suppl 63:3-10.
- Jones SM. Triggers of atopic dermatitis. Immunol Allergy Clin North Am 2002;22(1):55-72.
- Wiren K, Nohlgard C, Nyberg F, et al. Treatment with a barrier-strengthening moisturizing cream delays relapse of atopic dermatitis: a prospective and randomized controlled clinical trial. J Eur Acad Dermatol Venereol 2009;23(11):1267-72.
- Islam MZ, Ali ME, Wahab MA, Khondker L, Siddique MRU. Efficacy of topical mometasone furoate 0.1% cream in the treatment of atopic dermatitis. Med Today 2014;26(1):36-40.
- Boguniewicz M, Fiedler VC, Raimer S, Lawrence ID, Leung DY, Hanifin JM. A randomized, vehicle-controlled trial of tacrolimus ointment for treatment of atopic dermatitis in children. Pediatric Tacrolimus Study Group. J Allergy Clin Immunol 1998;102(4 Pt 1):637-44.
- Queille-Roussel C, Paul C, Duteil L, et al. The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for 4 weeks: a randomized, double-blind controlled study. Br J Dermatol 2001;144(3):507-13.
- Ma L, Zhang L, Kobayashi M, et al. Efficacy and safety of crisaborole ointment in Chinese and Japanese patients aged ≥2 years with mild-to-moderate atopic dermatitis. J Dermatol 2023;50:847-55.
- Ramsay CA, Savoie JM, Gilbert M, Gidon M, Kidson P. The treatment of atopic dermatitis with topical fusidic acid and hydrocortisone acetate. J Eur Acad Dermatol Venereol 1996;7:S15-S22.
- Goh MS, Yun JS, Su JC. Management of atopic dermatitis: a narrative review. Med J Aust 2022;216(11):587-93.
- Van Joost T, Heule F, Korstanje M, van den Broek MJ, Stenveld HJ, van Vloten WA. Cyclosporin in atopic dermatitis: a multicentre placebo-controlled study. Br J Dermatol 1994;130(5):634-40.
- Lee SS, Tan AW, Giam YC. Cyclosporin in the treatment of severe atopic dermatitis: a retrospective study. Ann Acad Med Singap 2004;33(3):311-3.
- Berth-Jones J, Takwale A, Tan E, et al. Azathioprine in severe adult atopic dermatitis: a double-blind, placebo-controlled, crossover trial. Br J Dermatol 2002;147(2):324-30.
- Tsakok T, Flohr C. Methotrexate vs. ciclosporin in the treatment of severe atopic dermatitis in children: a critical appraisal. Br J Dermatol 2014;170(3):496-8.
- Grundmann-Kollmann M, Podda M, Ochsendorf F, Boehncke W-H, Kaufmann R, Zollner TM. Mycophenolate mofetil is effective in the treatment of atopic dermatitis. Arch Dermatol 2001;137(7):870-3.
- Simpson EL, Bieber T, Guttman-Yassky E, et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med 2016;375(24):2335-48.
- Wollenberg A, Blauvelt A, Guttman-Yassky E, et al. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol 2021;184(3):437-49.
- Guttman-Yassky E, Teixeira HD, Simpson EL, et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet 2021;397(10290):2151-68.
- Ytterberg SR, Bhatt DL, Mikuls TR, et al. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022;386(4):316-26.
- Klein PA, Clark RA. An evidence-based review of the efficacy of antihistamines in relieving pruritus in atopic dermatitis. Arch Dermatol 1999;135(12):1522-5.
- Rodenbeck DL, Silverberg JI, Silverberg NB. Phototherapy for atopic dermatitis. Clin Dermatol 2016;34(5):607-13.



