Volume 41 Number 2
Budget impact of ceramide-infused skin barriers versus standard of care skin barriers for new ostomates: a six-country analysis
Ariel Berger, Gary Inglese, George Skountrianos, Davide Croce and Mustafa Oguz
Keywords ostomy, models, ceramides, economic evaluation, costs and cost analysis
For referencing Berger A et al. Budget impact of ceramide-infused skin barriers versus standard of care skin barriers for new ostomates: a six-country analysis. WCET® Journal 2021;41(2):22-31
DOI https://doi.org/10.33235/wcet.41.2.22-31
Abstract
Introduction In a randomised controlled study, the use of ceramide-infused skin barriers (CIB) resulted in lower costs of care over 12 weeks versus using a standard of care (SoC) skin barrier. However, the degree to which this information may influence prescribing patterns of ostomy products, and its corresponding impact on payers’ budgets, has not been examined.
Purpose To examine expected budget impact of CIB among recent ostomates in the United States (US), the United Kingdom (UK), Sweden, Australia, Italy and Norway.
Design A decision-analytic budget impact model.
Methods Total ostomy-related costs (i.e., skin barriers, ostomy accessories, care of peristomal skin complications [PSC]) were forecasted over 1 year for hypothetical cohorts of recent ostomates in each country of interest. Costs were assessed under two alternative scenarios – one in which all patients were assumed to use barriers other than CIB (the SoC scenario), and one in which 20% of patients were assumed to use CIB in lieu of SoC (the CIB scenario). The budget impact was assumed equal to the difference in these two scenarios.
Findings The use of CIB was expected to result in annual savings of US$6.6m in the US, £0.4m in the UK, SEK1.8m in Sweden, A$0.4m in Australia, €0.2m in Italy and NOK1.5m in Norway. Findings were consistent in sensitivity analyses.
Conclusions The use of CIB versus other barriers results in expected lower costs to the payers in each evaluated country. Further research is needed to better understand the complete clinical and economic benefits associated with the use of CIB.
Introduction
Faecal ostomy surgery is performed to treat both acute (e.g., trauma) and chronic (e.g., colorectal cancer, Crohn’s disease, ulcerative colitis) conditions. While effective for the underlying issue(s), an ostomy also has its own risk of complications, including peristomal skin complications (PSC) such as: mechanical, e.g., stripping or abraded skin; irritant dermatitis, typically caused by leakage that exposes the skin to ileostomy output; and infectious dermatitis. PSC are among the most commonly reported complications among ostomates, and may occur at any time following stoma creation1–3. Between 33.5% and 78.7% of ostomates report PSC4–11; one study estimated that 40% of consultations to ostomy clinics were for PSC12,. In 2011, the mean costs of care for PSC were estimated to range per ostomy from €32.45 for mild cases to €147.17 for severe cases, and the mean total costs of care (including ostomy pouching systems, accessories, visits to healthcare providers, hospitalisation and medications) over 7 weeks were shown to be approximately 22% greater among patients who experienced PSC versus those who did not5. PSC are also associated with deleterious impacts to quality of life, with a “loss” of approximately 11 quality-adjusted life-days (QALDs)/month for patients with severe PSC (versus no PSC)13.
CeraPlusTM is a novel skin barrier with Remois technology (Alcare Co Ltd, Sumida-ku, Tokyo, Japan) currently marketed by Hollister Inc. (Libertyville, Illinois, US). It is a ceramide-infused barrier (CIB) designed to support healthy peristomal skin. Ceramides are naturally occurring lipids that are essential to the barrier function of the skin and lipid bilayer of the stratum corneum14,15, and play an important role in the prevention of transepidermal water loss (TEWL) by fusing with corneocytes in the stratum corneum to help form a protective layer16,17.
In the ADVOCATE trial15 (a study determining variances in ostomy skin conditions and the economic impact: NCT02401412), 153 adults with healthy peristomal skin who had recently undergone ostomy surgery were randomly assigned to use CIB (n=79) or an alternative barrier (New Image FlexWear or New Image Flextend [Hollister Inc.]) (n=74). Over a maximum follow-up of 12 weeks (patients were assessed over 8 weeks, with those who experienced PSC observed for an additional 4-week “resolution period”), the mean costs of care among patients randomised to CIB were US$36.36 less than those randomised to control barrier (US$223.73 vs. US$260.19; p=0.017); they also were nominally less likely to experience PSC during follow-up15. A subsequent cost-effectiveness analysis indicated that the use of CIB among a hypothetical cohort of 100 Australian patients was expected, over 1 year, to result in 16 fewer PSC, an additional 35 QALDs, and a reduction in healthcare costs of A$13,700 (all versus standard of care [SoC]); the resulting net monetary benefit was A$17,400, indicating that CIB was a cost-effective alternative to SoC18.
Study/publication purpose
While CIB has been found to be cost-effective versus other barriers in both ADVOCATE and subsequent economic modelling, healthcare payers must also consider the overall expected impact to budgets (i.e., affordability) associated with the adoption of new technologies. Practitioners play an important role in the care of new ostomates, and are often asked to balance patients’ needs with cost-containment pressures imposed upon them by payers. Accordingly, findings presented herein are likely of great interest to nurse clinicians and other providers of care for this vulnerable population as it uses published information on patient-level efficacy and on the safety of CIB to estimate their expected value to payers.
To examine this and related questions, we developed a decision-analytic model that could estimate the budget impact associated with the use of CIB in lieu of other skin barriers. This model was estimated for the United States (US), the United Kingdom (UK), Sweden, Australia, Italy and Norway, based on information from ADVOCATE and supplemented with other sources where appropriate.
Methods and Procedures
Model overview
All patients were assumed to begin the model within 12 weeks of faecal stoma surgery outside hospital settings using either a CIB pouching system or a SoC system. The distribution of patients by ostomy type was assumed to be consistent with that reported by ADVOCATE and to be similar between patients who would use CIB versus SoC – 39%, 52% and 9% of subjects randomised to CIB in ADVOCATE had undergone ileostomy, colostomy and urostomy, respectively; corresponding values for subjects randomised to SoC were 36%, 54% and 10%, respectively; p=0.9715. We did not differentiate between type of ostomy as there was no statistically significant difference in the distribution of ostomy type at baseline in the ADVOCATE trial.
The model calculated the expected total 1-year ostomy-related medical costs under two alternative scenarios – one in which all patients were assumed to use barriers other than CIB (the SoC scenario), and one in which a percentage of patients were assumed to use CIB in lieu of SoC (the CIB scenario). We assumed that the SoC scenario represented any number of barriers from multiple manufacturers. Ostomy-related costs include ostomy pouching systems, ostomy accessories and PSC management, such as: specialist and nurse visits; facility fees (for US and Australia); topical steroids and antibiotics; and additional use of barriers, pouches and accessories due to increased frequency of barrier change. Budget impact was estimated by subtracting the total expected ostomy-related costs under the SoC scenario from those under the CIB scenario. The time horizon for the model was 1 year (i.e., 12 30-day months). Model programming was consistent with recommendations on budget impact analyses19. A schematic of the model is presented in Figure 1; key modelling assumptions are presented in Table 1.
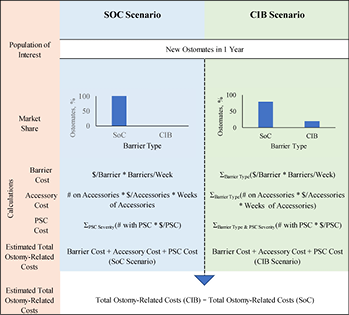
Figure 1. Model schematic
Table 1. Key modelling assumptions
Ostomy pouching systems and accessories
The use of ostomy pouching systems was based on country-specific information, as were the costs of healthcare services, including the 2018 Medicare schedule (US), the 2017–18 National Schedule of Reference Costs, NHS Trust and NHS Foundation Trusts (UK), the 2018 Regionala Priser Och Ersättningar för Södra Sjukvårdsregionen (Sweden), the 2019 (June) Stoma Appliance Scheme Schedule (Australia)20, the Sistema Socio Sanitario – Regione Lombardia (ATS Milano Città Metropolitana) (Italy), and the 2019 (January) Produkt-og Prisliste Refusjonsberettiget etter §5–14 Medisinsk Forbruksmateriell ved Stomi (Norway). Except for the UK, costs of CIB pouching systems were assumed equivalent to those of SoC systems. Values for all relevant parameters are provided in Appendix A.
The use of ostomy accessories (e.g., flat rings, ostomy belts, adhesive remover spray) was based on information from ADVOCATE unless more relevant country-specific data were available (Table 2). Accessory use was captured by means of an ‘average accessory use profile’ based on percentages of patients assumed to use each accessory, and the corresponding number of units and cost. Accessory use was assumed dependent on weekly frequency of change of pouching system.
Table 2. Accessory use, by country
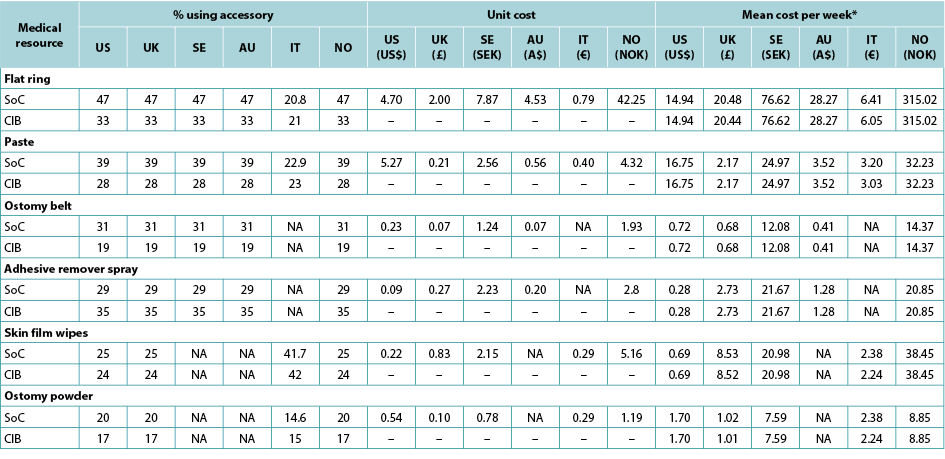
* Calculated using the average of the number of ostomy system changes per week, weighted by the proportions receiving one- and two-piece systems respectively.
PSC incidence
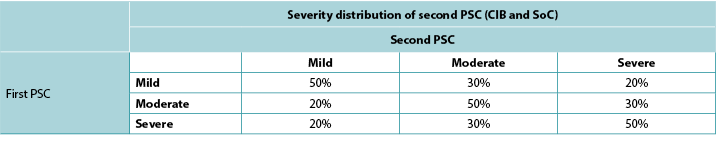
Consistent with ADVOCATE, we assumed that 55% of SoC patients and 41% of CIB patients would experience PSC; PSC severity distributions were taken from ADVOCATE (Figure 2). Given its relatively short follow-up, ADVOCATE was not used to estimate probability of a second PSC. Accordingly, we arbitrarily assumed that 10% of CIB patients would experience a second PSC, that the 5% risk difference observed in ADVOCATE was constant, and therefore that 15% of SoC patients would experience a second PSC. We also assumed that addition of accessories following the initial PSC would reduce the risk of subsequent PSC by 50% (i.e., 7.5% for SoC; 5% for CIB). The severity of the second PSC was dependent on that of the first (Table 3).
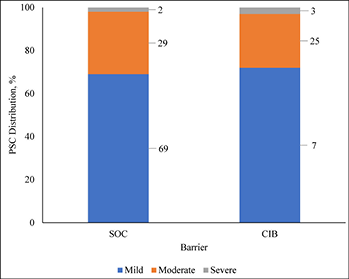
Figure 2. Distribution of PSC severity by barrier received
Table 3. Severity distribution of second PSC based on severity of first PSC
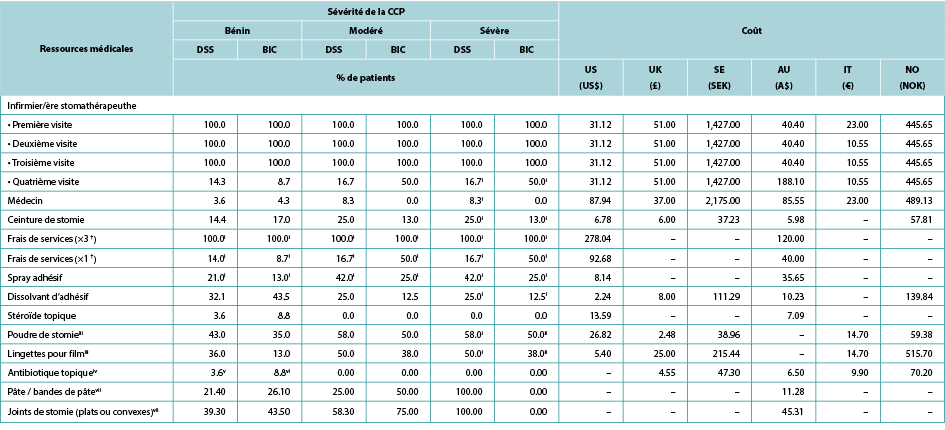
As per ADVOCATE, the time to PSC resolution was assumed to be 18 days for mild cases (defined in ADVOCATE as a Discoloration, Erosion, Tissue overgrowth [DET] score <4), and 33 days for moderate cases (4≤ DET <7) and severe cases (DET ≥7). Time to resolution was assumed invariant to barrier choice. Patterns of use of various healthcare services during PSC were based on information from ADVOCATE; while one-piece pouching systems were not evaluated, we assumed that these barriers would perform similarly to their two-piece counterparts. As per ADVOCATE, we assumed that the use of pouching supplies among CIB patients would increase by 29% for mild PSC, by 83% for moderate PSC, and by 83% for severe PSC; corresponding increases among SoC patients were 64%, 49% and 49%, respectively. We also assumed PSC management was similar in each country (Table 4).
Table 4. Use and cost of healthcare services during PSC, by PSC severity, barrier received, and country
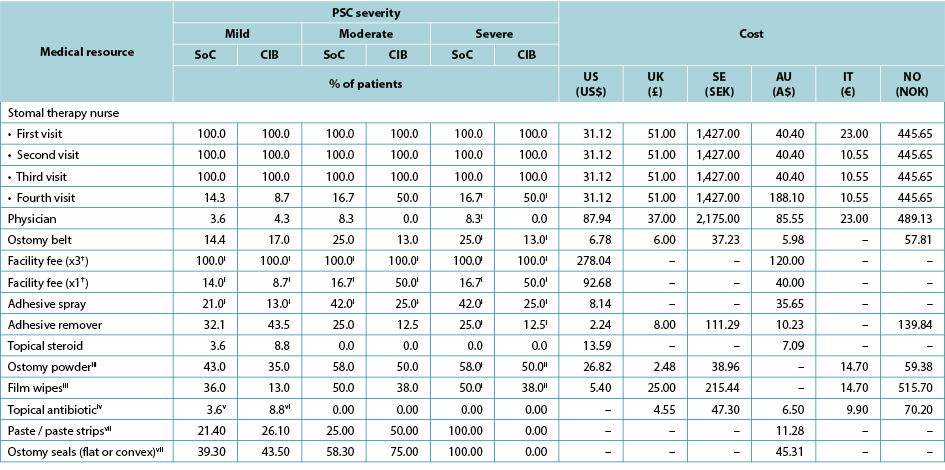
† Facility fee (x3) is the facility fee associated with the first three STN visits. Facility fee (x1) is the facility fee associated with the fourth STN visit.
i 0% for the UK, Sweden, Norway and Italy
ii 100% for the UK, Sweden, Norway and Italy
iii 0% in Australia
iv 0% in the US; values in the table are for the UK, Sweden, Norway and Italy
v 7.1 in Australia
vi 8.7 in Australia
vii Australia only
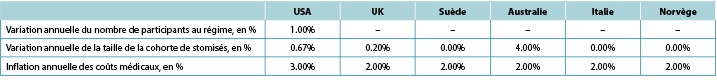
We assumed that there would be 149,000 ostomates in the US, 29,000 in the UK, 6,900 in Sweden, 9,000 in Australia, 17,000 in Italy and 3,700 in Norway. For the US, ostomates were assumed to be enrolled in a health plan comprised of 58,400,000 members; estimates of plan size were limited to the US as payers in the US tend to view estimates of budget impact in terms of costs per-member per-month (PMPM) which is estimated by dividing the expected cost by the total number of plan members and then dividing the resulting quotient by 12. Country-specific estimates of changes in population size (both plan members and number of ostomates) is presented in Table 5, as is the assumed annual inflation rate for medical costs.
Table 5. Country-specific estimates of changes in population size (both plan members and number of ostomates) and the assumed annual inflation rate for medical costs: assumptions for a 5-year analysis
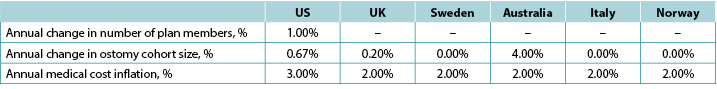
Note: Positive values denote expected increases; negative values expected decreases
Data Analysis
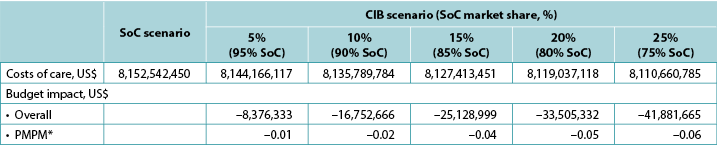
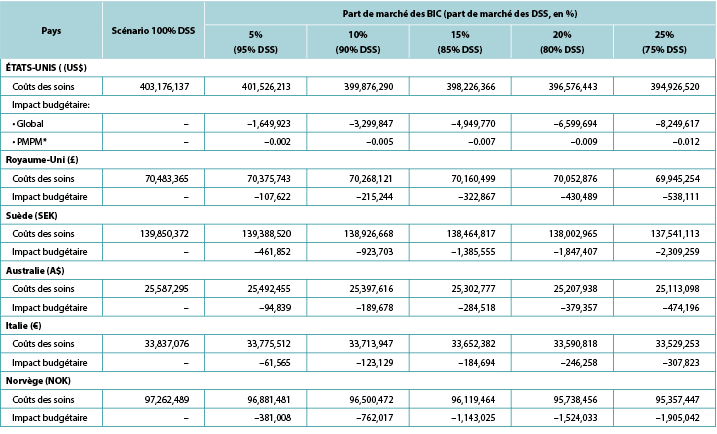
The model generated total expected numbers of expected PSC under both scenarios and corresponding expected ostomy-related costs, i.e., PSC-related care plus ostomy-related care. The 1-year budget impact was estimated by subtracting the total expected costs under the CIB scenario from those of the SoC scenario. We calculated the estimates of the budget impact alternatively, assuming uptake of CIB to be 5%, 10%, 15%, 20% and 25% (all versus 0% for the SoC scenario) (Table 6).
Table 6. 1-year budget impact results under different CIB scenarios
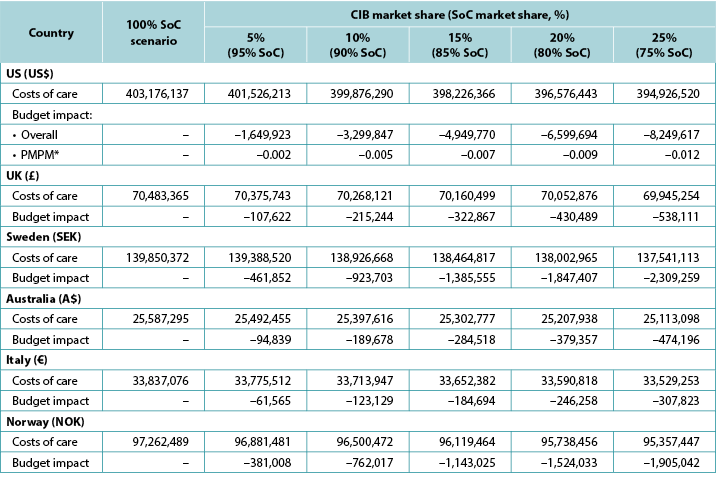
* Based on a plan with 58,400,000 members.
Note: Negative values denote expected savings.
We examined the 5-year expected budget impact of CIB, considering cost inflation and annual changes in ostomy cohort size; in addition, for the US, we estimated annual change in plan enrolment (Table 5). We also varied the uptake of CIB over time, assuming 5% would use these barriers in year 1 of the CIB scenario, 7.5% in year 2, 10.0% in year 3, 10.0% in year 4 and 10.0% in year 5 (all versus 0% for SoC) (Table 7).
Table 7. Expected annual budget impact of CIB over 5 years
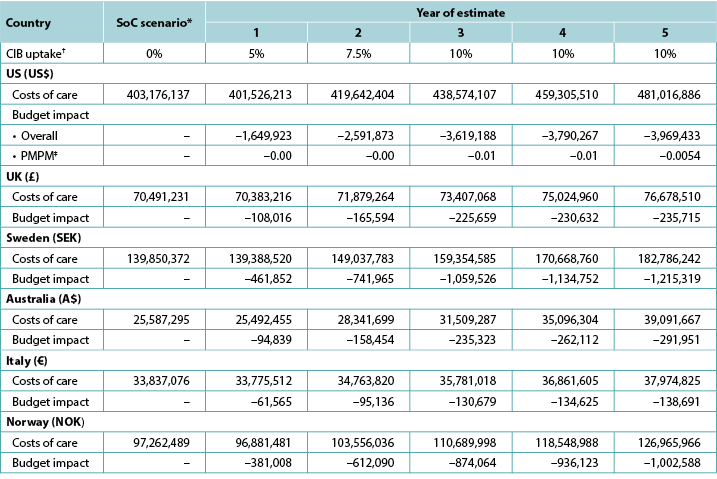
* Costs of care under the SoC scenario increase annually due to inflation and assumptions on cohort size.
† In each year of interest, all patients not assumed to use CIB were assumed to use SoC barriers.
‡ Based on a plan with 58,400,000 members.
Note: Negative values denote expected savings.
We conducted a sensitivity analysis in which the costs of PSC were changed to those reported in a retrospective study of ostomates identified in a US integrated healthcare system by Taneja and colleagues21; findings from their study indicated that patients who experienced PSC averaged US$8,031 more in all-cause medical-care costs over 120 days than those who did not (US$58,329 versus US$50,298; p=0.251)21. For this analysis, we used the model to estimate the incidence of PSC in both the SoC and CIB cohorts, and used these proportions to calculate average costs for a patient assumed to use SoC and CIB, respectively. We then multiplied these costs by the corresponding market shares for SoC and CIB, respectively, to calculate the expected budget impact of CIB. Due to the source of cost and utilisation estimates, this analysis was limited to the US.
We also conducted deterministic sensitivity analyses (DSA) to examine the sensitivity of model output to varying parameter values. In these analyses, each model parameter was varied to its lower and upper 95% confidence interval (CI) value, respectively.
Results
1-year model
Over 1 year, the total expected stoma-related costs for the SoC scenario were US$403.2m in the US, £70.5m in the UK, SEK139.9m in Sweden, A$25.6m in Australia, €33.8m in Italy, and NOK97.3m in Norway; corresponding values for the CIB scenario (20% of patients in each country assumed to use CIB in lieu of SoC; 80% used SoC) were US$396.6m, £70.1m, SEK138.0m, A$25.2m, €33.6m and NOK95.7m respectively. Resulting budget savings associated with CIB were therefore US$6.7m in the US, £0.4m in the UK, SEK1.8m in Sweden, A$0.4m in Australia, €0.2m in Italy, and NOK1.5m in Norway. As the use of CIB was expected to be cost-saving, the corresponding PMPM impact in the US was also expected to be cost-saving, although relatively small due to the large number of assumed plan members (Table 6).
5-year model
Five-year analyses yielded cost savings ranging from US$1.7m in year 1 to US$4.0m in year 5 in the US, from £0.1m in year 1 to £0.2m in year 5 in the UK, from SEK0.5m in year 1 to SEK1.2m in year 5 in Sweden, from A$0.09m in year 1 to A$0.3m in year 5 in Australia, from €0.06m in year 1 to €0.3m in year 5 in Italy, and from NOK0.4m in year 1 to NOK1.0m in year 5 in Norway (Table 7). Over the longer period, the use of CIB in a relatively limited population (i.e., a maximum of 10% of all eligible ostomates in any given year) resulted in expected cost savings of stoma-related care of US$15,620,684 in the US, £965,616 in the UK, SEK4,613,414 in Sweden, A$1,042,678 in Australia, €560,695 in Italy, and NOK3,805,873 in Norway.
Deterministic sensitivity analyses
The 20 variables for which budget impact results are most sensitive are presented for each country in Figures B1–B6 in Appendix B, i.e., one figure per country. Regardless of country, variables with the largest effect on budget impact were the percentage of patients using pouching supplies and accessories with relatively high unit costs, and the annual probability of PSC given the use of SoC barriers. In the US and Australia, CIB remained cost-saving across all DSAs conducted; in the other countries it was expected to be cost-saving in all sensitivity analyses except one ‘extreme’ scenario – the percentage of patients using more costly pouching supplies or accessories was set to the lower-bound 95% CI value of weekly costs for SoC and the higher-bound 95% CI value for CIB. In this extreme scenario, expected budget increases were <1% of annual costs of care expected under the SoC scenario (£207,042 in the UK, SEK116,916 in Sweden, €293,897 in Italy and NOK112,709 in Norway). In all countries evaluated, CIB was expected to be cost-saving when the probability of PSC with SoC was set to its lower-bound 95% CI value and the corresponding estimate for CIB was set to its higher-bound 95% CI value.
Scenario analysis
When we replaced cost inputs derived from ADVOCATE with those estimated using real-world US data over the 120-day period following ostomy surgery, resulting estimates of budget savings associated with an increased use of CIB were greater than those obtained in the base case (Table 8).
Table 8. Expected 1-year budget impact associated with the use of CIB and real-world healthcare costs in US patients
* Based on a plan with 58,400,000 members.
Discussion
Findings from our study suggests that the use of CIB in lieu of other skin barriers is expected to result in savings to payers within 1 year. The magnitude of expected savings is dependent on the percentage of ostomates who would use CIB instead of other skin barriers. Estimates of impact were greatest for the US (from US$1.7m at 5% CIB to US$8.3m at 25% CIB), and lowest for Norway (from NOK381,008 [US$43,321] at 5% CIB to NOK1,905,042 [US$216,603] at 25% CIB)22. Estimates for the US were substantially larger than those expected for other countries of interest, likely due to its relatively high costs of medical care (including accessories) versus the other countries included in this evaluation. CIB was expected to result in lower costs of care (i.e., savings) across all six countries assessed.
Results were fairly robust in sensitivity analyses. 5-year projections of budget impact were most heavily influenced by assumptions of market share of CIB, although additional payer savings were projected simply by increasing the number of ostomates and/or costs of medical care, respectively. Similarly, results of the scenario analysis that used real-world US costs of PSC as opposed to ADVOCATE (i.e., approximately US$8,000 versus US$36.46 over a 12-week period) also projected increased savings in all scenarios (versus SoC) relative to the base case, irrespective of assumed CIB uptake. However, this scenario included all-cause healthcare costs, not only those specific to ostomy care. Unsurprisingly, CIB was found to be cost-saving across nearly all DSA scenarios, with the model being most sensitive to the percentages of patients using relatively expensive pouching supplies and accessories and PSC incidence. In the one ‘extreme’ instance where the use of CIB was expected to increase total costs, the resulting budget impact represented a very modest increase in annual costs of care. Findings were consistent across all countries assessed.
While the economic value of pharmaceutical products (in terms of cost-effectiveness and budgetary impact) have been assessed for decades, comparatively less is typically done for medical devices. This is somewhat counter-intuitive, as the number of devices coming to market vastly exceed that of pharmaceuticals. In 2012, over 10,000 patent applications for medical devices were filed in Europe, which was approximately twice that for pharmaceuticals23. As opposed to cost-effectiveness analyses, which focus on the benefits of the assessed technology at the patient level, budget impact analyses examine affordability to the payer. In our opinion, this question of affordability is of equal importance. In fact, assessments of budget impact are “…an ‘essential’ part of comprehensive economic assessment of medical technology”24.
This issue is perhaps even more important in fields such as ostomy, in which nurse clinicians and other providers are often tasked with a dual, often competing, role to provide quality care while simultaneously containing costs. Accordingly, the use of economic models based on evidence obtained from randomised trials and other well-conducted studies is an important means by which healthcare professionals, payers and other interested parties can estimate the value of a given product based on its efficacy and safety. Results of such models can then be used to help align these parties on cost-effective, high-quality patient care.
We implemented principles of good practice for budget impact analyses, as set forth by the International Society for Pharmacoeconomics and Outcomes Research (ISPOR)19, including our reliance on ADVOCATE, a randomised clinical trial, for most input values used in the model, as well as the inclusion of sensitivity analyses to better understand the degree to which model output relied on inputs and assumptions. Results of our analyses are consistent with those of ADVOCATE15 and the published cost-effectiveness model18, and provide evidence that the value of CIB enjoyed by patients also manifests as cost savings to payers across various countries.
Limitations
Our study has several limitations. First, like all economic models, ours presents a somewhat simplified view of clinical practice, such as limiting to a maximum of two the incidence of PSC during 1 year, including a maximum of one PSC during an ‘early’ (i.e., 12-week) period and a maximum of one PSC during a ‘late’ (i.e., 40-week) period. The degree to which these assumptions adequately capture actual patient experience is not known. On a related matter, in the absence of data, we arbitrarily – and somewhat conservatively – set risk of a second PSC. The model also does not differ between ostomy types (e.g., ileostomy, colostomy) in terms of PSC risk, use of skin barriers, and/or use of accessories.
The economic and clinical impacts of CIB are based on findings from ADVOCATE, including but not limited to the incidence of PSCs (55% of SoC patients vs. 41% of CIB patients), and the distribution of patients by ostomy type (about one-third had an ileostomy; about one-half had a colostomy; and all other patients had a urostomy). Further study is needed to better understand the impact of CIB in different populations, both in terms of distribution by ostomy type as well as with different demographic and/or comorbidity profiles than subjects enrolled in ADVOCATE.
We also assumed that publicly available country-specific unit costs for various items used in stoma-related care were adequate representations of what is spent on care of ostomy patients by payers in each country. However, the degree to which this assumption is true for the US – which has many different types of payers (e.g., private commercial insurance, Medicare) and, within some payer types, equal if not more heterogeneity across insurers in terms of reimbursement policies – and other countries of interest in unknown.
Furthermore, while ADVOCATE was limited to the use of two-piece systems, we assumed the use of both one- and two-piece systems, and that benefits of CIB would be consistent across both types of systems. We also assumed that PSC were of fixed duration. However, other studies have reported resolution times varying between 7 weeks to over 3 months4,5,25; consequently, our analyses may have underestimated the economic consequence of PSC. We note, however, that to the degree this occurred, estimated budget impact associated with the use of CIB in lieu of other skin barriers is likely conservative, i.e., the ‘true’ magnitude of savings resulting from the use of CIB may be greater than what is estimated herein.
Conclusions
The use of CIB results in expected cost reductions to payers in the US, UK, Sweden, Australia, Italy and Norway, with the magnitude of expected reductions directly related to percentages of patients assumed to use CIB in lieu of SoC. While our findings are consistent with those of ADVOCATE and previous cost-effectiveness modelling, further research is needed to better understand the economic consequences of the use of CIB (versus other skin barriers) in clinical practice.
Conflict of Interest
Gary W Inglese and George Skountrianos are employees of Hollister Incorporated. Ariel Berger and Mustafa Oguz are employees of Evidera Inc. which provides consulting and other research services to pharmaceutical, device, government and non-government organisations. Evidera Inc. received funding from Hollister Incorporated in connection with conducting this study and with developing this manuscript. Davide Croce is an employee of the Università Carlo Cattaneo and did not receive any funding for the conduct of this study or for the development of this manuscript.
Funding
Funding for this research was provided by Hollister Incorporated.
Impact budgétaire des barrières cutanées imprégnées de céramides par rapport aux barrières cutanées de soin standard pour les nouveaux stomisés: une analyse portant sur six pays
Ariel Berger, Gary Inglese, George Skountrianos, Davide Croce and Mustafa Oguz
DOI: https://doi.org/10.33235/wcet.41.2.22-31
Résumé
Introduction Dans une étude contrôlée randomisée, l’utilisation de barrières cutanées imprégnées de céramides (BIC) a permis de réduire les coûts des soins sur 12 semaines par rapport à l’utilisation d’une barrière cutanée de soin standard (DSS). Cependant, le degré auquel cette information peut influencer les schémas de prescription des produits pour stomie, et son impact correspondant sur les budgets des payeurs, n’a pas été examinée.
Objectif Examiner l’impact budgétaire attendu de la BIC chez les nouveaux stomisés aux États-Unis (USA), au Royaume-Uni (UK), en Suède, en Australie, en Italie et en Norvège.
Projet Un modèle d’analyse décisionnelle de l’impact budgétaire.
Méthodes Les coûts totaux liés aux stomies (c’est-à-dire les barrières cutanées, les accessoires de stomie, les soins des complications cutanées péristomiales [CCP]) ont été prévus sur un an pour des cohortes hypothétiques de stomisés récents dans chaque pays concerné. Les coûts ont été évalués selon deux scénarios alternatifs: l’un dans lequel tous les patients étaient supposés utiliser des barrières autres que BIC (le scénario DSS), et l’autre dans lequel 20 % des patients étaient supposés utiliser des BIC au lieu de DSS (scénario BIC). L’impact budgétaire a été supposé égal à la différence entre ces deux scénarios.
Conclusions L’utilisation de BIC devait permettre de réaliser des économies annuelles de 6,6 millions de dollars aux États-Unis, de 0,4 million de livres au Royaume-Uni, de 1,8 million de couronnes suédoises en Suède, de 0,4 million de dollars australiens en Australie, de 0,2 million d’euros en Italie et de 1,5 million de couronnes norvégiennes en Norvège. Les résultats étaient cohérents dans les analyses de sensibilité.
Conclusions L’utilisation de BIC par rapport à d’autres barrières permet de réduire les coûts pour les payeurs dans chaque pays évalué. Des recherches supplémentaires sont nécessaires pour mieux comprendre l’ensemble des avantages cliniques et économiques associés à l’utilisation de BIC.
Introduction
La chirurgie pour colostomie est pratiquée pour traiter des affections aiguës (par exemple, un traumatisme) et chroniques (par exemple, un cancer colorectal, la maladie de Crohn, une colite ulcéreuse). Bien qu’efficace pour le(s) problème(s) sous-jacent(s), une stomie comporte également un risque propre de complications, y compris les complications cutanées péristomiales (CCP) telles que: les complications mécaniques, par exemple le décapage ou l’abrasion de la peau ; la dermatite irritative, généralement causée par une fuite qui expose la peau à l’écoulement de l’iléostomie ; et la dermatite infectieuse. Les CCP font partie des complications les plus fréquemment rapportées chez les stomisés, et peuvent survenir à tout moment après la création de la stomie1-3. Entre 33,5% et 78,7% des stomisés font état d’une CCP4-11 ; une étude a estimé que 40% des consultations dans les cliniques pour stomies concernaient une CCP12,. En 2011, on a estimé que les coûts moyens des soins pour les CCP variaient par stomie de 32,45 € pour les cas bénins à 147,17 € pour les cas sévères, et il a été démontré que les coûts totaux moyens des soins (y compris les systèmes de poche de stomie, les accessoires, les visites chez les prestataires de soins, l’hospitalisation et les médicaments) sur 7 semaines étaient environ 22% plus élevés chez les patients souffrant de CCP que chez les autres5. Les CCP sont également associées à des impacts délétères sur la qualité de vie, avec une “perte“ d’environ 11 jours de vie ajustés à la qualité (QALD) par mois pour les patients atteints de CCP sévère (par rapport à l’absence de CCP)13.
CeraPlus™ est une nouvelle barrière cutanée dotée de la technologie Remois (Alcare Co Ltd, Sumida-ku, Tokyo, Japon) actuellement commercialisée par Hollister Inc. (Libertyville, Illinois, États-Unis). Il s’agit d’une barrière infusée de céramides (BIC) conçue pour favoriser la santé de la peau péristomiale. Les céramides sont des lipides naturels essentiels à la fonction de barrière de la peau et à la bicouche lipidique de la couche cornée14,15, et jouent un rôle important dans la prévention de la perte d’eau transépidermique (PETE) en fusionnant avec les cornéocytes de la couche cornée pour aider à former une couche protectrice16,17.
Dans l’essai ADVOCATE15 (une étude déterminant les variations des affections cutanées de stomie et l’impact économique: NCT02401412), 153 adultes présentant une peau péristomiale saine et ayant récemment subi une opération de stomie ont été répartis au hasard pour utiliser une BIC (n=79) ou une barrière alternative (New Image FlexWear ou New Image Flextend [Hollister Inc.]) (n=74). Sur un suivi maximal de 12 semaines (les patients ont été évalués sur 8 semaines, ceux qui ont souffert de CCP étant observés pendant une “période de résolution” supplémentaire de 4 semaines) les coûts moyens des soins chez les patients randomisés dans le groupe BIC étaient inférieurs de 36,36 $ US à ceux des patients randomisés dans le groupe témoin (223,73 $ US contre 260,19 $ US ;
p=0,017) ; ils étaient également nominalement moins susceptibles de connaître une CCP pendant le suivi15. Une analyse coût-efficacité ultérieure a indiqué que l’utilisation de BIC dans une cohorte hypothétique de 100 patients australiens devrait, sur une période d’un an, entraîner 16 CCP de moins, 35 QVQA supplémentaires et une réduction des coûts de santé de 13 700 dollars australiens (tous par rapport au standard de soins (DSS)) ; le bénéfice financier net résultant était de 17 400 dollars australiens, indiquant que les BIC étaient une alternative rentable aux DSS18.
Objectif de l’étude/publication
Bien que les BIC se soient avérées rentables par rapport à d’autres barrières dans le cadre d’ADVOCATE et de modélisations économiques ultérieures, les payeurs de soins de santé doivent également tenir compte de l’impact global attendu sur les budgets (c’est-à-dire l’accessibilité financière) associé à l’adoption de nouvelles technologies. Les praticiens jouent un rôle important dans les soins aux nouveaux stomisés, et on leur demande souvent de trouver un équilibre entre les besoins des patients et les pressions pour limiter les coûts que leur imposent les payeurs. Par conséquent, les résultats présentés ici sont susceptibles de présenter un grand intérêt pour les infirmiers et infirmières praticiens et les autres prestataires de soins pour cette population vulnérable, dans la mesure où ils utilisent l’information publiée sur l’efficacité au niveau du patient et sur la fiabilité de la BIC pour estimer la valeur attendue pour les payeurs.
Pour examiner cette question et d’autres questions connexes, nous avons mis au point un modèle d’analyse décisionnelle permettant d’estimer l’impact budgétaire associé à l’utilisation de BIC au lieu d’autres barrières cutanées. Ce modèle a été estimé pour les États-Unis (USA), le Royaume-Uni (UK), la Suède, l’Australie, l’Italie et la Norvège, sur la base des informations fournies par ADVOCATE et complétées par d’autres sources pertinentes.
Méthodes et Procédures
Aperçu du modèle
Il était présumé que tous les patients commençaient le modèle dans les 12 semaines suivant une opération de colostomie, en dehors du milieu hospitalier, en utilisant soit un système de poche BIC, soit un système DSS. La distribution des patients par type de stomie a été supposée être cohérente avec celle rapportée par ADVOCATE et être similaire entre les patients qui utiliseraient des BIC et ceux qui utiliseraient des DSS - 39%, 52% et 9% des sujets randomisés pour les BIC dans ADVOCATE avaient subi respectivement iléostomie, colostomie et urostomie; les valeurs correspondantes pour les sujets randomisés pour les DSS étaient de 36%, 54% et 10%, respectivement ; p=0,9715. Nous n’avons pas fait de distinction entre les types de stomie car il n’y avait pas de différence statistiquement significative dans la distribution des types de stomie comme base dans l’essai ADVOCATE.
Le modèle a calculé le total attendu des coûts médicaux liés à la stomie sur un an selon deux scénarios alternatifs: l’un dans lequel tous les patients sont supposés utiliser des barrières autres que BIC (le scénario DSS), et l’autre dans lequel un pourcentage de patients est supposé utiliser des BIC au lieu de DSS (le scénario BIC). Nous avons supposé que le scénario DSS représentait un nombre quelconque de barrières provenant de plusieurs fabricants. Les coûts liés à la stomie comprennent les systèmes de poche de stomie, les accessoires de stomie et la gestion de la CCP, tels que: les visites de spécialistes et d’infirmiers et infirmières ; les frais de services (pour les États-Unis et l’Australie) ; les stéroïdes topiques et les antibiotiques ; ainsi que l’utilisation supplémentaire de barrières, de poches et d’accessoires en raison de la fréquence accrue de changement de barrière. L’impact budgétaire a été estimé en soustrayant le total des coûts liés à la stomie attendus dans le scénario DSS de ceux du scénario BIC. L’horizon temporel du modèle était de 1 an (c’est-à-dire 12 mois de 30 jours). La programmation du modèle était conforme aux recommandations sur les analyses d’impact budgétaire19. Un schéma du modèle est présenté dans la figure 1 ; les principales hypothèses de modélisation sont présentées dans le Tableau 1.

Figure 1. Schéma du modèle
Tableau 1. Principales hypothèses de modélisation
Systèmes de poche de stomie et accessoires
L’utilisation de systèmes de poche de stomie était basée sur des informations spécifiques à chaque pays, tout comme les coûts des services de santé, notamment le barème Medicare 2018 (États-Unis), le barème national des coûts de référence 2017-18, NHS Trust et NHS Foundation Trusts (Royaume-Uni), le Regionala Priser Och Ersattningar for Sodra Sjukvardsregionen 2018 (Suède), le Stoma Appliance Scheme Schedule 2019 (juin) (Australie)20, le Sistema Socio Sanitario - Regione Lombardia (ATS Milano Città Metropolitana) (Italie), et le Produkt- og Prisliste Refusjonsberettiget etter §5-14 Medisinsk Forbruksmateriell ved Stomi 2019 (janvier) (Norvège). À l’exception du Royaume-Uni, les coûts des systèmes de poche BIC ont été considérés comme équivalents à ceux des systèmes DSS. Les valeurs de tous les paramètres pertinents sont fournies dans l’annexe A.
L’utilisation d’accessoires de stomie (par exemple, anneaux plats, ceintures de stomie, spray dissolvant) était basée sur l’information fournie par ADVOCATE, à moins que des données plus pertinentes spécifiques à chaque pays ne soient disponibles (Tableau 2). L’utilisation des accessoires a été saisie au moyen d’un “profil d’utilisation moyen des accessoires” basé sur les pourcentages de patients supposés utiliser chaque accessoire, ainsi que le nombre d’unités et le coût correspondants. L’utilisation d’accessoires a été supposée dépendre de la fréquence hebdomadaire de changement du système de poche.
Tableau 2. Utilisation des accessoires, par pays
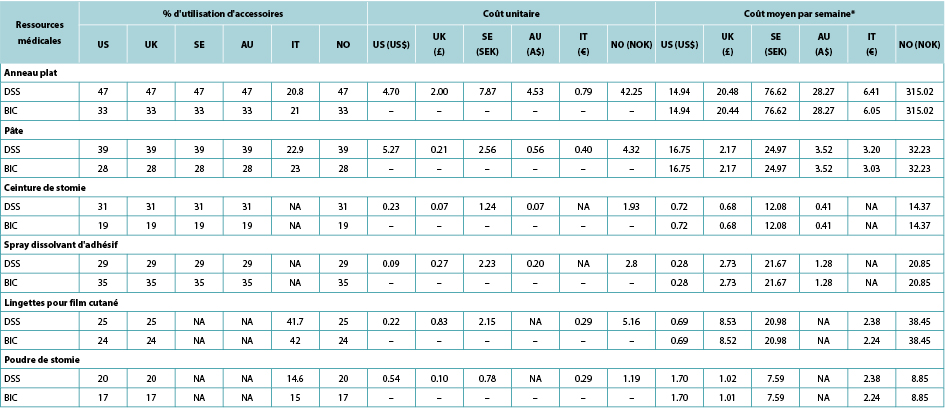
* Calculé en utilisant la moyenne du nombre de changements d’appareillage de stomie par semaine, pondérée par les proportions recevant respectivement des appareillages à une ou deux pièces.
Incidence des CCP
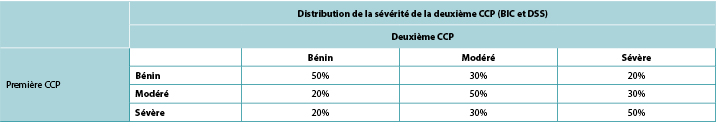
Conformément à ADVOCATE, nous avons supposé que 55% des patients DSS et 41% des patients BIC présenteraient une CCP ; les distributions de sévérité des CCP ont été tirées d’ADVOCATE (Figure 2). Compte tenu de son suivi relativement court, ADVOCATE n’a pas été utilisé pour estimer la probabilité d’une seconde CCP. Par conséquent, nous avons arbitrairement supposé que 10% des patients BIC connaîtraient une seconde CCP, que la différence de risque de 5% observée dans ADVOCATE était constante, et donc que 15% des patients DSS connaîtraient une seconde CCP. Nous avons également supposé que l’ajout d’accessoires après la CCP initiale réduirait de 50% le risque de CCP ultérieure (c’est-à-dire 7,5% pour les DSS et 5% pour les BIC). La sévérité de la deuxième CCP dépendait de celle de la première (Tableau 3).

Figure 2. Distribution de sévérité des CCP en fonction de la barrière reçue
Tableau 3. Répartition de la sévérité de la deuxième CCP en fonction de la sévérité de la première CCP
Conformément à ADVOCATE, le délai de résolution des CCP a été supposé être de 18 jours pour les cas bénins (définis dans ADVOCATE comme un score de décoloration, érosion, surcroissance tissulaire [DET] <4), et de 33 jours pour les cas modérés (4≤ DET<7) et les cas sévères (DET ≥7). Le temps de résolution a été supposé invariable en fonction du choix de la barrière. Les schémas d’utilisation de divers services de santé pendant la CCP ont été basés sur l’information fournie par ADVOCATE ; bien que les systèmes de poche à une pièce n’aient pas été évalués, nous avons supposé que ces barrières fonctionneraient de manière similaire à leurs homologues à deux pièces. Conformément à ADVOCATE, nous avons supposé que l’utilisation de fournitures pour poche chez les patients BIC augmenterait de 29% pour les CCP bénines, de 83% pour les CCP modérées et de 83% pour les CCP sévères ; les augmentations correspondantes chez les patients DSS étaient respectivement de 64%, 49% et 49%. Nous avons également supposé que la gestion des CCP était similaire dans chaque pays (Tableau 4).
Tableau 4. Utilisation et coût des services de santé pendant la CCP, selon: sévérité de la CCP, barrière reçue et pays
† Frais d’établissement (×3) correspond aux frais d’établissement associés aux trois premières visites STN. Les frais d’établissement (×1) sont les frais d’établissement associés à la quatrième visite STN.
i 0% pour le Royaume-Uni, la Suède, la Norvège et l’Italie
ii 100% pour le Royaume-Uni, la Suède, la Norvège et l’Italie
iii 0% en Australie
iv 0% aux États-Unis ; les valeurs du tableau concernent le Royaume-Uni, la Suède, la Norvège et l’Italie
v 7.1 en Australie
vi 8.7 en Australie
vii Australie uniquement
Nous avons supposé qu’il y aurait 149 000 stomisés aux États-Unis, 29 000 au Royaume-Uni, 6 900 en Suède, 9 000 en Australie, 17 000 en Italie et 3 700 en Norvège. Pour les États-Unis, nous avons supposé que les stomisés étaient inscrits dans un régime de santé comprenant 58 400 000 membres ; les estimations de la taille des régimes ont été limitées aux États-Unis car les payeurs américains ont tendance à considérer les estimations de l’impact budgétaire en termes de coûts par membre par mois (PMPM), estimation réalisée en divisant le coût attendu par le nombre total de membres du régime, puis en divisant le quotient résultant par 12. Les estimations par pays de l’évolution de la taille de la population (à la fois les partcipants au régime et le nombre de stomisés) sont présentées dans le Tableau 5, ainsi que le taux d’inflation annuel supposé pour les coûts médicaux.
Tableau 5. Estimations par pays de l’évolution de la taille de la population (à la fois les participants au régime et le nombre de stomisés) et du taux d’inflation annuel supposé pour les coûts médicaux: hypothèses pour une analyse sur 5 ans
Note: Les valeurs positives indiquent les augmentations attendues ; les valeurs négatives les diminutions attendues
Analyse des Données
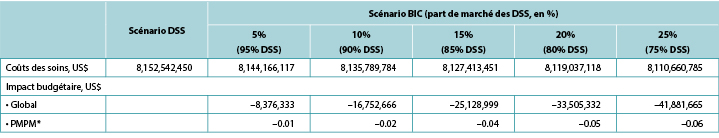
Le modèle a généré le nombre total attendu de CCP attendues dans les deux scénarios et les coûts liés à la stomie attendus correspondants, c’est-à-dire les soins liés à la CCP plus les soins liés à la stomie. L’impact budgétaire sur un an a été estimé en soustrayant les coûts totaux prévus dans le cadre du scénario BIC de ceux du scénario DSS. Nous avons calculé les estimations de l’impact budgétaire alternativement, en supposant que l’adoption de BIC soit de 5%, 10%, 15%, 20% et 25% (tous contre 0% pour le scénario DSS) (Tableau 6).
Tableau 6. Résultats de l’impact budgétaire sur un an selon différents scénarios BIC
* Sur la base d’un régime comptant 58 400 000 participants.
Note: Les valeurs négatives indiquent les économies attendues.
Nous avons examiné l’impact budgétaire attendu des BIC sur 5 ans, en tenant compte de l’inflation des coûts et des changements annuels de la taille de la cohorte de stomisés ; en outre, pour les États-Unis, nous avons estimé le changement annuel des inscriptions au régime (Tableau 5). Nous avons également fait varier l’adoption des BIC dans le temps, en supposant que 5% utiliseraient ces barrières la première année du scénario BIC, 7,5% la deuxième année, 10,0% la troisième année, 10,0% la quatrième année et 10,0% la cinquième année (tous contre 0% dans le scénario DSS) (Tableau 7).
Tableau 7. Impact budgétaire annuel attendu des BIC sur 5 ans
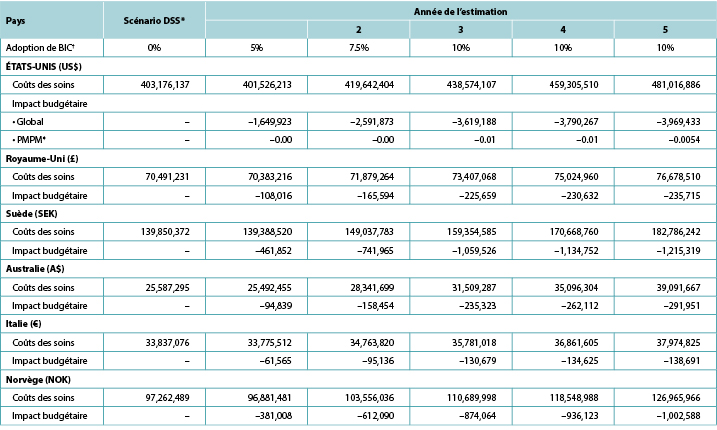
* Les coûts des soins dans le cadre du scénario DSS augmentent chaque année en raison de l’inflation et des hypothèses sur la taille de la cohorte.
† Pour chaque année considérée, tous les patients non supposés utiliser des BIC ont été supposés utiliser des barrières DSS.
‡ Basé sur un régime comptant 58 400 000 participants.
Note: Les valeurs négatives indiquent les économies attendues.
Nous avons effectué une analyse de sensibilité dans laquelle les coûts des CCP ont été modifiés en fonction de ceux rapportés dans une étude rétrospective des stomisés identifiés dans un système de soins de santé intégré américain par Taneja et ses collègues21 ; les résultats de leur étude ont indiqué que les patients ayant connu une CCP généraient en moyenne 8 031 $ US de plus en coûts de soins médicaux toutes causes confondues sur 120 jours que ceux qui n’en avaient pas connu (58 329 $ US contre 50 298 $ US ; p=0,251)21. Pour cette analyse, nous avons utilisé le modèle pour estimer l’incidence des CCP à la fois dans les cohortes DSS et BIC, et utilisé ces proportions pour calculer les coûts moyens pour un patient supposé utiliser soit des DSS soit des BIC. Nous avons ensuite multiplié ces coûts par les parts de marché correspondantes respectivement pour les DSS et les BIC, afin de calculer l’impact budgétaire attendu des CIB. En raison de la source des estimations de coûts et d’utilisation, cette analyse s’est limitée aux États-Unis.
Nous avons également effectué des analyses de sensibilité déterministes (ASD) afin d’examiner la sensibilité des résultats du modèle aux valeurs variables des paramètres. Dans ces analyses, on a fait varier chaque paramètre du modèle respectivement en fonction de la valeur inférieure et supérieure de son intervalle de confiance (IC) à 95%.
Résultats
Modèle d’un an
Sur une période d’un an, le total attendu des coûts liés à la stomie pour le scénario DSS était de 403,2 millions de dollars aux États-Unis, 70,5 millions de livres au Royaume-Uni, 139,9 millions de couronnes suédoises en Suède, 25,6 millions de dollars australiens en Australie, 33,8 millions d’euros en Italie et 97,3 millions de couronnes norvégiennes en Norvège. Les valeurs correspondantes pour le scénario BIC (20% des patients dans chaque pays sont supposés utiliser des BIC au lieu de DSS ; 80% utilisent des DSS) étaient respectivement de 396,6 millions de dollars US, 70,1 millions de livres sterling, 138,0 millions de couronnes suédoises, 25,2 millions de dollars australiens, 33,6 millions d’euros et 95,7 millions de couronnes norvégiennes. Les économies budgétaires avérées associées aux BIC se sont donc élevées à 6,7 millions de dollars américains aux États-Unis, 0,4 million de livres sterling au Royaume-Uni, 1,8 million de couronnes suédoises en Suède, 0,4 million de dollars australiens en Australie, 0,2 million d’euros en Italie et 1,5 million de couronnes norvégiennes en Norvège. Comme l’utilisation de BIC était censée être économique, l’impact PMPM correspondant aux États-Unis était également censé être économique, bien que relativement faible en raison du grand nombre de participants au régime supposé (Tableau 6).
Modèle de 5 ans
Les analyses sur cinq ans ont permis de réaliser des économies allant de 1,7 million de dollars US la première année à 4,0 millions de dollars US la cinquième année aux États-Unis, de 0,1 million de livres sterling la première année à 0,2 million de livres sterling la cinquième année au Royaume-Uni, de 0,5 million de couronnes suédoises la première année à 1,2 million de couronnes suédoises la cinquième année en Suède, de 0,09 million de dollars australiens la première année à 0,3 million la cinquième année en Australie, de 0,06 million d’euros la première année à 0,3 million la cinquième année en Italie, et de 0,4 million de couronnes norvégiennes la première année à 1,0 million la cinquième année en Norvège (Tableau 7). Sur une période plus longue, l’utilisation de BIC dans une population relativement limitée (c’est-à-dire un maximum de 10% de tous les stomisés admissibles au cours d’une année donnée) a permis de réaliser des économies sur les soins liés à la stomie de 15 620 684 dollars US aux États-Unis, 965 616 livres au Royaume-Uni, 4 613 414 SEK en Suède, 1 042 678 dollards australiens en Australie, 560 695 € en Italie et 3 805 873 NOK en Norvège.
Analyses de sensibilité déterministes
Les 20 variables pour lesquelles les résultats de l’impact budgétaire sont les plus sensibles sont présentées pour chaque pays dans les figures B1-B6 de l’annexe B, soit une figure par pays. Quel que soit le pays, les variables ayant le plus d’effet sur l’impact budgétaire étaient le pourcentage de patients utilisant des appareillages et des accessoires de stomie au coût unitaire relativement élevé, et la probabilité annuelle de CCP compte-tenu de l’utilisation de barrières DSS. Aux États-Unis et en Australie, les BIC sont restées plus économiques dans toutes les ASD réalisées ; dans les autres pays, elles étaient supposées être plus économiques dans toutes les analyses de sensibilité, à l’exception d’un scénario “extrême“: le pourcentage de patients utilisant des appareillages ou des accessoires de stomie plus coûteux a été fixé à la valeur inférieure de l’IC à 95% des coûts hebdomadaires pour les DSS et à la valeur supérieure de l’IC à 95% pour les BIC. Dans ce scénario extrême, les augmentations budgétaires attendues étaient inférieures à 1% des coûts annuels des soins attendus dans le scénario DSS
(207 042 £ au Royaume-Uni, 116 916 SEK en Suède, 293 897 € en Italie et 112 709 NOK en Norvège). Dans tous les pays évalués, les BIC étaient supposées permettre de réaliser des économies lorsque la probabilité de CCP avec DSS était fixée à sa valeur inférieure de l’IC à 95% et que l’estimation correspondante pour les BIC était fixée à sa valeur supérieure de l’IC à 95%.
Analyse de scénarios
Lorsque nous avons remplacé les intrants de coûts dérivés d’ADVOCATE par ceux estimés à l’aide de données américaines réelles sur la période de 120 jours suivant l’opération de stomie, les estimations des économies budgétaires associées à une utilisation accrue de BIC étaient supérieures à celles obtenues dans le scénario de base (Tableau 8).
Tableau 8. Impact budgétaire attendu sur un an associé à l’utilisation de BIC et coûts réels des soins de santé chez les patients aux États-Unis
* Sur la base d’un régime comptant 58 400 000 participants.
Discussion
Les résultats de notre étude suggèrent que l’utilisation de BIC à la place d’autres barrières cutanées devrait permettre aux payeurs de réaliser des économies sur une période d’un an. L’ampleur des économies attendues dépend du pourcentage de stomisés qui utiliseraient des BIC au lieu d’autres barrières cutanées. Les estimations de l’impact étaient les plus élevées pour les États-Unis (de 1,7 million de dollars pour 5% de BIC à 8,3 millions de dollars pour 25% de BIC), et les plus faibles pour la Norvège (de
381 008 couronnes norvégiennes [43 321 dollars] pour 5% de BIC à 1 905 042 couronnes norvégiennes [216 603 dollars] pour 25% de BIC)22. Les estimations pour les États-Unis étaient sensiblement plus élevées que celles attendues pour les autres pays considérés, probablement en raison de leurs coûts relativement élevés de soins médicaux (y compris les accessoires) par rapport aux autres pays inclus dans cette évaluation. Les BIC devaient entraîner une baisse du coût des soins (c’est-à-dire des économies) dans les six pays évalués.
Les résultats étaient assez solides dans les analyses de sensibilité. Les projections sur 5 ans de l’impact budgétaire ont été le plus fortement influencées par les hypothèses de part de marché des BIC, bien que des économies supplémentaires pour les payeurs aient été projetées simplement en augmentant respectivement le nombre de stomisés et/ou les coûts des soins médicaux. De même, les résultats de l’analyse de scénario qui a utilisé les coûts américains réels des CCP au lieu de ceux d’ADVOCATE (c’est-à-dire environ 8 000 dollars US contre 36,46 dollars sur une période de 12 semaines) ont également prévu une augmentation des économies dans tous les scénarios (sauf DSS) par rapport au cas de base, indépendamment de l’adoption supposée de BIC. Cependant, ce scénario incluait les coûts des soins de santé toutes causes confondues, et pas seulement ceux spécifiques aux soins des stomies. Comme on pouvait s’y attendre, les BIC se sont avérées plus économiques dans presque tous les scénarios d’DSA, le modèle étant plus sensible aux pourcentages de patients utilisant des appareillages et accessoires de stomie relativement coûteux ainsi qu’à l’incidence des CCP. Dans le seul cas “extrême” où l’on s’attendait à ce que l’utilisation de BIC augmente les coûts totaux, l’impact budgétaire résultant représentait une augmentation très modeste des coûts annuels des soins. Les résultats sont cohérents dans tous les pays évalués.
Alors que la valeur économique des produits pharmaceutiques (en termes de coût-efficacité et d’impact budgétaire) est évaluée depuis des dizaines d’années, on en fait comparativement moins pour les dispositifs médicaux. Cela est quelque peu contre-intuitif, car le nombre de dispositifs mis sur le marché dépasse largement celui des produits pharmaceutiques. En 2012, plus de 10 000 demandes de brevet pour des dispositifs médicaux ont été déposées en Europe, soit environ deux fois plus que pour les produits pharmaceutiques23. Contrairement aux analyses coût-efficacité, qui se concentrent sur les avantages de la technologie évaluée au niveau du patient, les analyses d’impact budgétaire examinent l’accessibilité financière pour le payeur. À notre avis, cette question de l’accessibilité financière est d’une importance égale. De fait, les évaluations de l’impact budgétaire sont une partie “essentielle” de l’évaluation économique complète des technologies médicales”24.
Cette question est peut-être encore plus importante dans des domaines tels que la stomie, dans lesquels les infirmiers et infirmières praticiens et les autres prestataires de soins sont souvent chargés d’un double rôle, souvent concurrent, consistant à fournir des soins de qualité tout en limitant les coûts. Par conséquent, l’utilisation de modèles économiques fondés sur des données obtenues à partir d’essais randomisés et d’autres études bien menées constitue un important moyen pour les professionnels de la santé, les payeurs et les autres parties concernées d’estimer la valeur d’un produit donné en fonction de son efficacité et de sa sécurité. Les résultats de ces modèles peuvent ensuite être utilisés pour aider à aligner ces parties sur des soins aux patients rentables et de haute qualité.
Nous avons appliqué les principes de bonne pratique pour les analyses d’impact budgétaire, tels que définis par l’International Society for Pharmacoeconomics and Outcomes Research (ISPOR)19, notamment en nous appuyant sur ADVOCATE, un essai clinique randomisé, pour la plupart des valeurs d’entrée utilisées dans le modèle, ainsi qu’en incluant des analyses de sensibilité pour mieux comprendre dans quelle mesure les résultats du modèle dépendent des entrées et des hypothèses. Les résultats de nos analyses sont cohérents avec ceux d’ADVOCATE15 et du modèle coût-efficacité publié18, et apportent la preuve que la valeur ajoutée des BIC dont bénéficient les patients se manifeste également par des économies pour les payeurs dans divers pays.
Les limites
Notre étude présente plusieurs limites. Tout d’abord, comme tous les modèles économiques, le nôtre présente une vision quelque peu simplifiée de la pratique clinique, par exemple en limitant à un maximum de deux l’incidence des CCP au cours d’une année, dont un maximum d’une CCP au cours d’une période “précoce“ (c’est-à-dire de 12 semaines) et un maximum d’une CCP au cours d’une période “tardive“ (c’est-à-dire de 40 semaines). On ne sait pas dans quelle mesure ces hypothèses reflètent de manière adéquate les complications que connaissent réellement des patients. Dans un domaine connexe, en l’absence de données, nous avons fixé arbitrairement - et de manière quelque peu conservatrice - le risque d’une deuxième CCP. Le modèle ne diffère pas non plus entre les types de stomie (par exemple, iléostomie, colostomie) en termes de risque de CCP, d’utilisation de barrières cutanées et/ou d’utilisation d’accessoires.
Les impacts économiques et cliniques des BIC sont basés sur les résultats de l’étude ADVOCATE, y compris, mais sans s’y limiter, l’incidence des CCP (55% des patients DSS contre 41% des patients BIC), et sur la distribution des patients par type de stomie (environ un tiers avait une iléostomie ; environ la moitié avait une colostomie ; et tous les autres patients avaient une urostomie). D’autres études sont nécessaires pour mieux comprendre l’impact des BIC dans différentes populations, tant en termes de distribution par type de stomie que de profils démographiques et/ou de comorbidité différents de ceux des sujets inscrits dans ADVOCATE.
Nous avons également supposé que les coûts unitaires spécifiques au pays disponibles publiquement pour divers articles utilisés dans les soins liés aux stomies étaient des représentations adéquates de ce qui est dépensé pour les soins des patients stomisés par les payeurs dans chaque pays. Toutefois, on ne sait pas dans quelle mesure cette hypothèse est vraie pour les États-Unis - qui comptent de nombreux types de payeurs différents (par exemple, assurance commerciale privée, Medicare) et, au sein de certains types de payeurs, une hétérogénéité égale, voire supérieure, entre les assureurs en termes de politiques de remboursement - et pour les autres pays concernés.
En outre, alors qu’ADVOCATE se limitait à l’utilisation de systèmes à deux pièces, nous avons supposé l’utilisation aussi bien de systèmes à une qu’à deux pièces, et que les avantages des BIC seraient cohérents pour les deux types de systèmes. Nous avons également supposé que les CCP avaient une durée fixe. Cependant, d’autres études ont rapporté des délais de résolution variant entre 7 semaines et plus de 3 mois4,5,25; par conséquent, nos analyses peuvent avoir sous-estimé les conséquences économiques des CCP. Nous notons cependant que, dans la mesure où cela s’est produit, l’impact budgétaire estimé associé à l’utilisation de BIC au lieu d’autres barrières cutanées est probablement conservateur, c’est-à-dire que l’ampleur “réelle“ des économies résultant de l’utilisation de BIC peut être supérieure à ce qui est estimé ici.
Conclusions
L’utilisation de BIC entraîne des réductions de coûts attendues pour les payeurs aux États-Unis, au Royaume-Uni, en Suède, en Australie, en Italie et en Norvège, l’ampleur des réductions attendues étant directement liée aux pourcentages de patients supposés utiliser des BIC au lieu de DSS. Bien que nos résultats soient cohérents avec ceux d’ADVOCATE et des modélisations coût-efficacité précédentes, des recherches supplémentaires sont nécessaires pour mieux comprendre les conséquences économiques de l’utilisation de BIC (par rapport à d’autres barrières cutanées) dans la pratique clinique.
Conflit D’intérêt
Gary W Inglese et George Skountrianos sont des employés de Hollister Incorporated. Ariel Berger et Mustafa Oguz sont employés d’Evidera Inc., qui fournit du conseil et d’autres services de recherche à des organisations pharmaceutiques, fabricantes d’appareils médicaux, gouvernementales et non gouvernementales. Evidera Inc. a reçu un financement de Hollister Incorporated dans le cadre de la réalisation de cette étude et de l’élaboration de cet article. Davide Croce est un employé de l’Université Carlo Cattaneo et n’a reçu aucun financement pour la réalisation de cette étude ou pour l’élaboration de cet article.
Financement
Le financement de cette recherche a été assuré par Hollister Incorporated.
Author(s)
Ariel Berger* MPH
Executive Director, Integrated Solutions – RWE
Evidera, 500 Totten Pond Road, 5th Floor, Waltham, MA 02451, USA
Email ariel.berger@evidera.com
Gary Inglese RN, MBA
Senior Director, Market Access
Hollister Incorporated, Libertyville, IL, USA
George Skountrianos MS
Statistician, Global Clinical Affairs
Hollister Incorporated, Libertyville, IL, USA
Davide Croce MBA
Aggregate Professor
Research Center in Health Economics, Social and Healthcare Management, Università Carlo Cattaneo–LIUC, Castellanza (Va), Italy
Mustafa Oguz PhD
Senior Research Associate, Data Analytics
Evidera Inc., Hammersmith, London, UK
* Corresponding author
References
- Alvey B, Beck DE. Peristomal dermatology. Clin Colon Rectal Surg 2008;21(1):41–44.
- Doctor K, Colibaseanu DT. Peristomal skin complications: causes, effects, and treatments. Chronic Wound Care Manag Res 2017;2017(4):1–6.
- Rolstad BS, Erwin-Toth PL. Peristomal skin complications: prevention and management. Ostomy Wound Manage 2004;50(9):68–77.
- Herlufsen P, Olsen AG, Carlsen B, et al. Study of peristomal skin disorders in patients with permanent stomas. Br J Nurs 2006;15(16):854–862.
- Meisner S, Lehur PA, Moran B, Martins L, Jemec GB. Peristomal skin complications are common, expensive, and difficult to manage: a population based cost modeling study. PLoS One 2012;7(5):e37813.
- Richbourg L, Thorpe JM, Rapp CG. Difficulties experienced by the ostomate after hospital discharge. J Wound Ostomy Continence Nurs 2007;34(1):70–79.
- Salvadalena GD. The incidence of stoma and peristomal complications during the first 3 months after ostomy creation. J Wound Ostomy Continence Nurs 2013;40(4):400–406.
- Taneja C, Netsch D, Rolstad BS, Inglese G, Lamerato L, Oster G. Clinical and economic burden of peristomal skin complications in patients with recent ostomies. J Wound Ostomy Continence Nurs 2017;44(4):350–357.
- Maeda S, Ouchi A, Komori K, et al. Risk factors for peristomal skin disorders associated with temporary ileostomy construction. Surg Today 2021.
- Shiraishi T, Nishizawa Y, Nakajima M, et al. Risk factors for the incidence and severity of peristomal skin disorders defined using two scoring systems. Surg Today 2020;50(3):284–291.
- Voegeli D, Karlsmark T, Eddes EH, et al. Factors influencing the incidence of peristomal skin complications: evidence from a multinational survey on living with a stoma. Gastrointest Nurs 2020;18(Sup4):S31–S38.
- Jemec GB, Nybaek H. Peristomal skin problems account for more than one in three visits to ostomy nurses. Br J Dermatol 2008;159(5):1211–1212.
- Nichols TR, Inglese GW. The burden of peristomal skin complications on an ostomy population as assessed by health utility and the physical component summary of the SF-36v2®. Value Hlth 2018;21(1):89–94.
- Coderch L, Lopez O, de la Maza A, Parra JL. Ceramides and skin function. Am J Clin Dermatol 2003;4(2):107–129.
- Colwell JC, Pittman J, Raizman R, Salvadalena G. A randomized controlled trial determining variances in ostomy skin conditions and the economic impact (ADVOCATE trial). J Wound Ostomy Continence Nurs 2018;45(1):37–42.
- Hollister Inc. The CeraPlus skin barrier product evaluation: clinicians’ feedback; 2017 [cited 2017 Nov 8]. Available from: https://www.hollister.no/-/media/files/pdfs-for-download/ostomy-clinical-evaluations-and-case-studies-pdfs/ceraplus-product-evaluation-113015.ashx.
- Hollister Inc. CeraPlus skin barrier; 2017 [cited 2020 Apr 21]. Available from: https://www.hollister.com/en/ceraplus.
- Berger A, Inglese G, Skountrianos G, Karlsmark T, Oguz M. Cost-effectiveness of a ceramide-infused skin barrier versus a standard barrier: findings from a long-term cost-effectiveness analysis. J Wound Ostomy Continence Nurs 2018;45(2):146–155.
- Mauskopf JA, Sullivan SD, Annemans L, et al. Principles of good practice for budget impact analysis: report of the ISPOR Task Force on good research practices – budget impact analysis. Value Hlth 2007;10(5):336–347.
- Australian Department of Health. Stoma Appliance Scheme – schedule; 2017 [cited 2017 Nov 8]. Available from: http://www.health.gov.au/internet/main/publishing.nsf/Content/AB1C0973EEA98E14CA257BF0001E01C4/$File/sas-schedule-1-july-2017-full.pdf.
- Taneja C, Netsch D, Rolstad BS, Inglese G, Eaves D, Oster G. Risk and economic burden of peristomal skin complications following ostomy surgery. J Wound Ostomy Continence Nurs 2019;46(2):143–149.
- ExchangeRates.org.uk. Euro to US dollar spot exchange rates for 2019; 2019 [cited 2020 Apr 21]. Available from: https://www.exchangerates.org.uk/EUR-USD-spot-exchange-rates-history-2019.html.
- Craig JA, Carr L, Hutton J, Glanville J, Iglesias CP, Sims AJ. A review of the economic tools for assessing new medical devices. Appl Health Econ Health Policy 2015;13(1):15–27.
- Neumann PJ. Budget impact analyses get some respect. Value Hlth 2007;10(5):324–325.
- Persson E, Berndtsson I, Carlsson E, Hallen AM, Lindholm E. Stoma-related complications and stoma size – a 2-year follow up. Colorectal Dis 2010;12(10):971–976.
Appendix A. Pouching Supply Use
With the exception of the UK, the costs of CIB pouching systems were assumed equivalent to those of SoC systems. In the UK, the per package cost of one-piece flat closed, convex closed, flat drainable, and convex drainable systems were £87.75, £98.70, £97.95 and £135.75 for SoC; and £88.68, £99.90, £106.42 and £144.31 for CIB, respectively. The baseplate and pouch package cost for two-piece systems were £20.00 and £1.69, respectively, for both SoC flat and convex systems, £22.24 and £1.69 for CIB flat systems, and £22.72 and £1.69 for CIB convex systems. Pouching supply use parameters are provided in Tables A1 to A6 below.
Table A1. Pouching supply use: US
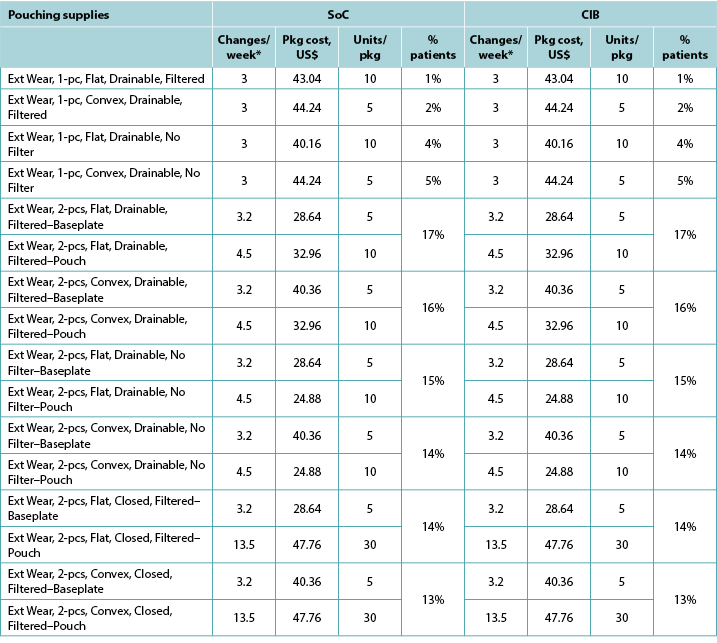
Table A2. Pouching supply use: UK
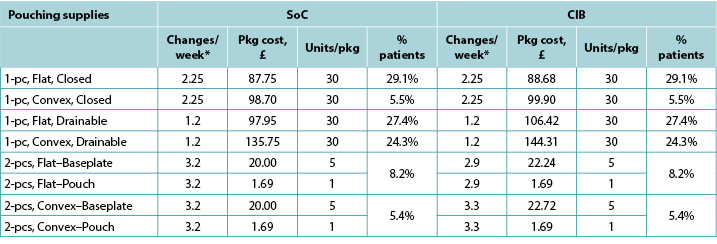
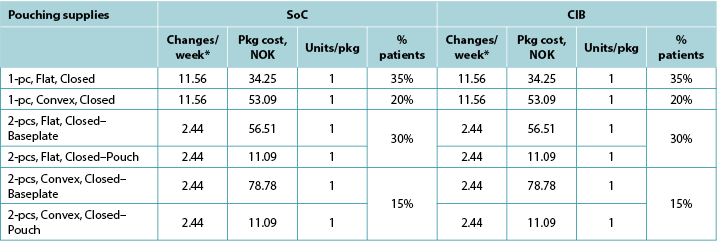
Table A3. Pouching supply use: Sweden
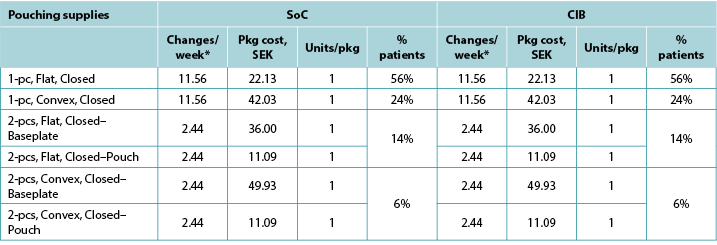
Table A4. Pouching supply use: Australia
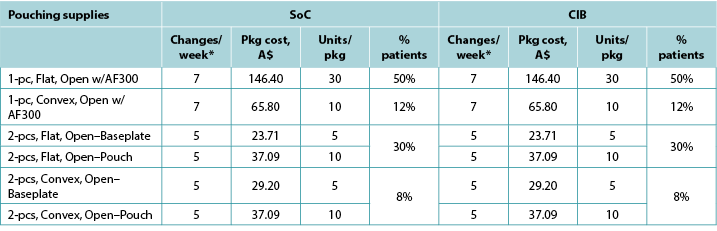
Table A5. Pouching supply use: Italy
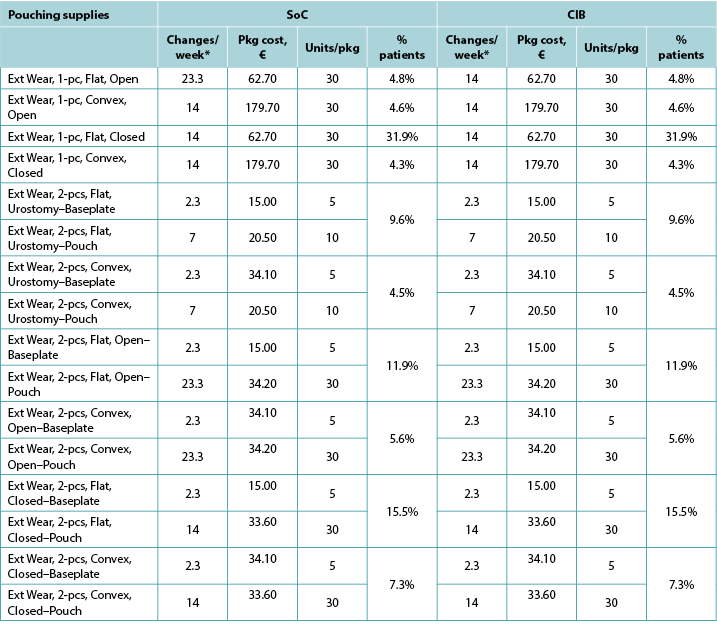
Table A6. Pouching supply use: Norway
Appendix B. DSA of Expected Budget Impact, by Country
Expected budget impact associated with the use of a CIB versus SoC among patients within 12 weeks of faecal ostomy surgery in Australia, Italy, Norway, Sweden, the UK and the US.
Please note: Figure B1. DSA of expected budget impact: US, was not available at time of publishing
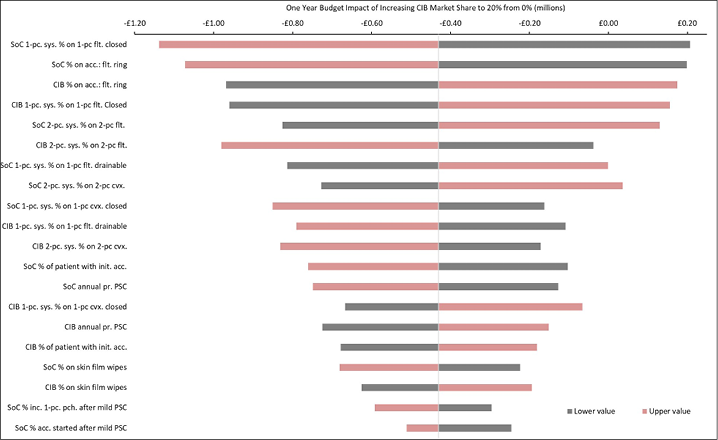
Figure B2. DSA of expected budget impact: UK
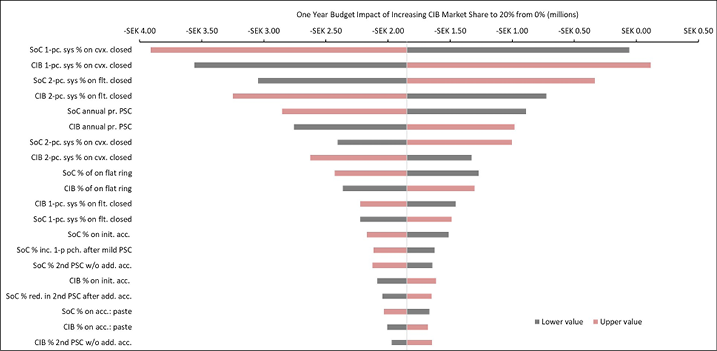
Figure B3. DSA of expected budget impact: Sweden
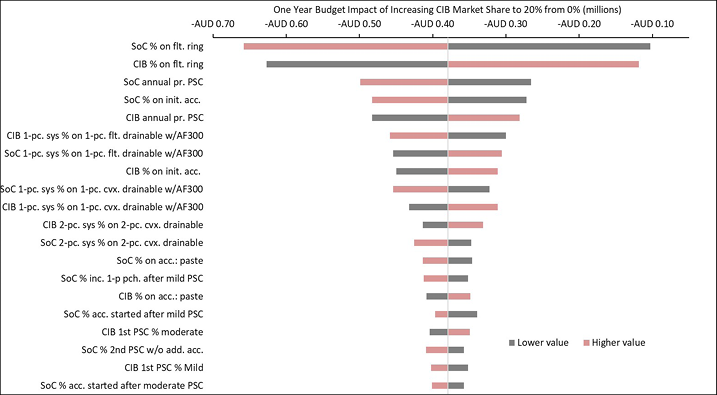
Figure B4. DSA of expected budget impact: Australia
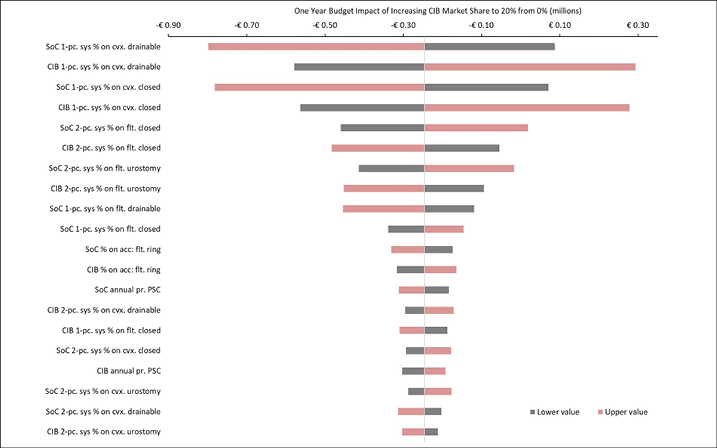
Figure B5. DSA of expected budget impact: Italy
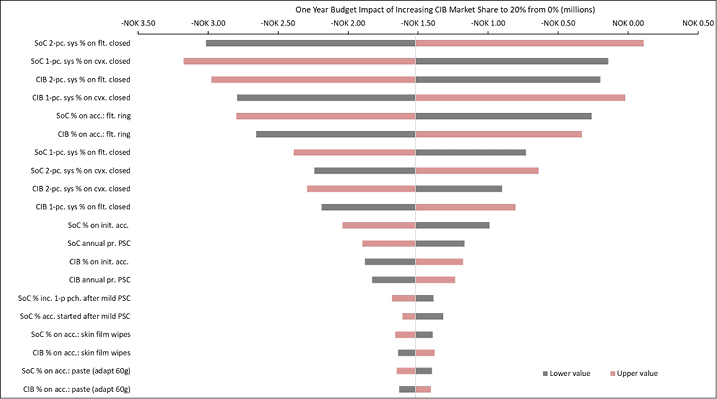
Figure B6. DSA of expected budget impact: Norway
